Chyba każdy wie, że wiązanie wodorowe tak naprawdę nie jest wiązaniem, a raczej oddziaływaniem międzycząsteczkowym. Jest jednak w swojej naturze tak silne i tak znacząco wpływa na właściwości związków w których występuje, że być może z tego względu chemicy nadali mu miano “wiązania”. Problem pojawia się jednak, jeżeli maturzysta ma określić, który związek może wytwarzać wiązania między własnymi cząsteczkami, a który nie. W tym artykule wyjaśnię wszystkie znaczące z aspektu licealnego niejasności. Do dzieła.
1.Wyjaśnienie znaczenia wiązania wodorowego.
Wiązanie wodorowe jest kluczowe w aspekcie życia, które powstało i wyewoluowało na naszej planecie. Wszystko za sprawą tego, że znacząco obniża lotność związków, które mają zdolność do tworzenia wiązań wodorowych między własnymi cząsteczkami. Z tego też względu cząsteczka wody (H2O – 18g/mol) w warunkach panujących na powierzchni Ziemi jest cieczą, a nie gazem!!!. Cząsteczki o masie podobnej do wody (lub większej) zawierające wodór, ale nie wytwarzające wiązań wodorowych są w warunkach ziemskich gazami. Dla porównania spójrzmy na poniższy rysunek (Rys. 1).
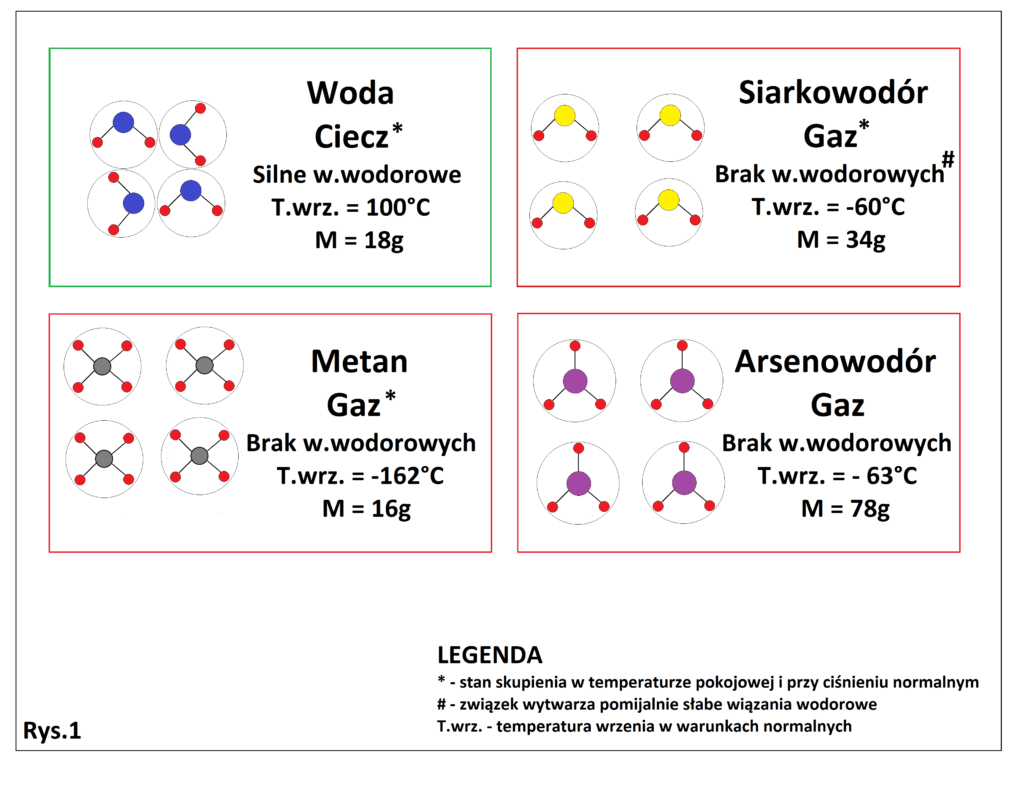
Na rysunku widać, że nawet AsH3, którego masa molowa jest ponad 4 razy większa od wody jest w warunkach pokojowych gazem, co pokazuje jak wielkie znaczenie mogą mieć wiązania wodorowe w aspekcie lotności związków. Gdyby nie wiązania wodorowe występujące w wodzie, to H2O byłoby w warunkach ziemskich gazem, a to uniemożliwiłoby rozwój życia na naszej planecie, bądź powstałe życie wyglądałoby zupełnie inaczej. Można to nazwać naukowym cudem, jeżeli pomyślimy jak wyglądałaby alternatywna wersja Wszechświata w którym nie występowałyby wiązania wodorowe.
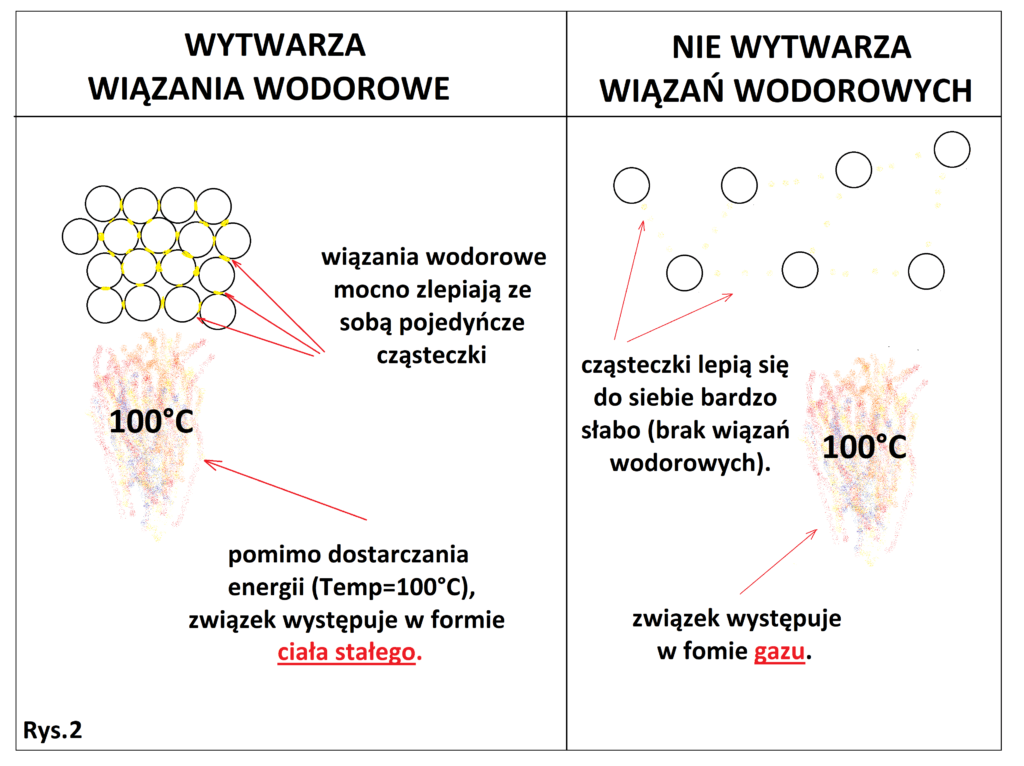
Należałoby zadać sobie pytanie: “W jaki sposób występowanie wiązań wodorowych wpływa na obniżenie lotności związków?”. Aby to lepiej zrozumieć, możemy utożsamić oddziaływania międzycząsteczkowe z “klejem”, który zlepia ze sobą cząsteczki. W przypadku wiązań wodorowych, klej ten jest bardzo silny, co powoduje, że należy dostarczyć o wiele więcej energii (temperatury), aby odlepić od siebie cząsteczki i przeprowadzić je do postaci gazowej w porównaniu do innych rodzajów wiązań międzycząsteczkowych (Rys. 2).
Warto zaznaczyć, że poza kwestią stanu skupienia wody, wiązania wodorowe są również istotne w aspekcie budowy naszego materiału genetycznego, czy też stabilizacji struktury bialek!
Reasumując, związki wytwarzające wiązania wodorowe między własnymi cząsteczkami mają:
- wyższą temperaturę wrzenia względem związków nie wytwarzających wiązań wodorowych i mających podobną masę
- mniejszą lotność względem związków nie wytwarzających wiązań wodorowych i mających podobną masę
2. Warunki konieczne do powstania wiązania wodorowego.
Aby związek mógł wytwarzać wiązanie wodorowe musi spełnić następujące warunki: (Rys. 3)

Należy jeszcze zaznaczyć rzecz może mniej istotną, ale również ważną. Owy elektroujemnie naładowany atom musi posiadać również wolną parę elektronową.
Należy jednak uściślić, że czym innym jest możliwość wytwarzania wiązań wodorowych między własnymi cząsteczkami, a czym innym wytwarzanie wiązań z innymi cząsteczkami. Zacznijmy od kwestii istotniejszej =>
3. Wytwarzanie wiązań wodorowych między własnymi cząsteczkami.
Wśród związków, które mogą wytwarzać wiązania wodorowe między własnymi cząsteczkami możemy wymienić: H2O, HF, Kwasy karboksylowe, Aminy, Amidy, Alkohole oraz wiele innych. Jaka wspólna cecha łączy te związki? Wiązanie wodorowe jest swego rodzaju magnesem, tj. można to w pewien sposób utożsamić z rodzajem przyciągania elektrostatycznego między mocno naładowanym ujemnie atomem jednej cząsteczki, a naładowanym dodatnio wodorem drugiej.
Tak więc dany związek musi mieć możliwość wytworzenia zarówno ładunku ujemnego (-) w jednym fragmencie cząsteczki jak i ładunku dodatniego (+) w drugim, aby następnie móc wytworzyć nimi wiązanie wodorowe.
Sytuacja taka może nastąpić tylko w przypadku, w którym owy “-” naładowany atom jest bezpośrednio związany z wodorem. Dla przykładu spójrzmy na wzór strukturalny metanolu i przeanalizujmy dlaczego może wytwarzać wiązania wodorowe między własnymi cząsteczkami (Rys. 4).
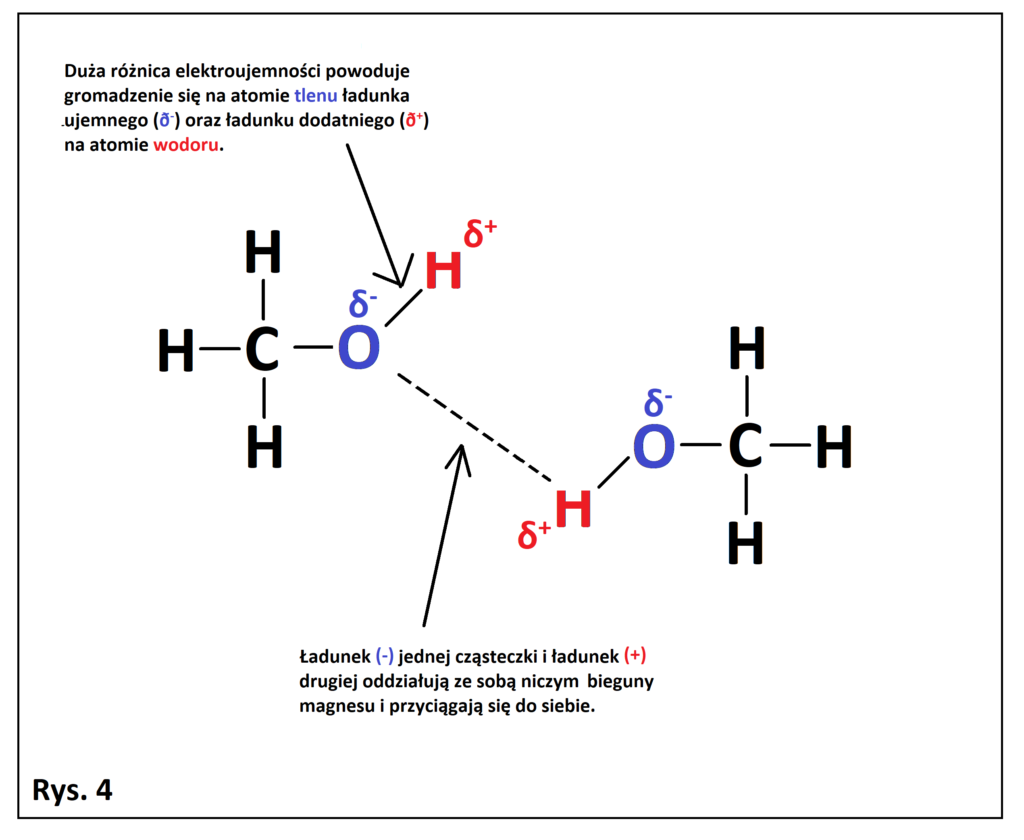
Aby owy “magnes” mógł powstać, atom o wysokiej elektroujemności (N, O, F) musi być bezpośrednio połączony z atomem wodoru. Spójrzmy na poniższy rysunek (Rys. 5), który dobrze pokazuje w jakich przypadkach mogą powstać wiązania wodorowe między własnymi cząsteczkami, a w jakich nie. Zielony kolor oznacza, że związek może wytwarzać wiązania wodorowe między własnymi cząsteczkami, a czerwony kolor, że nie może wytwarzać wiązań wodorowych

4. Wytwarzanie wiązań wodorowych z innymi cząsteczkami.
Jeszcze parę lat temu zadania okołomaturalne roiły się od niedopowiedzeń i uproszczeń traktując zdolność do tworzenia wiązań wodorowych między własnymi cząsteczkami i z cząsteczkami innych związków jako jedną i tą samą rzecz.
I tak, jeżeli zadalibyśmy sobie pytanie czy aceton (propanon) może wytwarzać wiązania wodorowe, to większa część uczniów odpowie – NIE, ponieważ atom tlenu nie jest połączony bezpośrednio z atomem wodoru. I byłaby to prawda, jednak tylko połowiczna. Aceton nie może wytwarzać wiązań wodorowych między własnymi cząsteczkami, ale jednocześnie może wytwarzać wiązania wodorowe chociażby z cząsteczkami wody. Z tego też względu aceton jest dobrze mieszalny z wodą. O co więc konkretnie chodzi? Analizując poniższy rysunek (Rys. 6), widzimy że z uwagi na brak bezpośredniego połączenia atomu tlenu z atomem wodoru, na tlenie zgromadzony jest
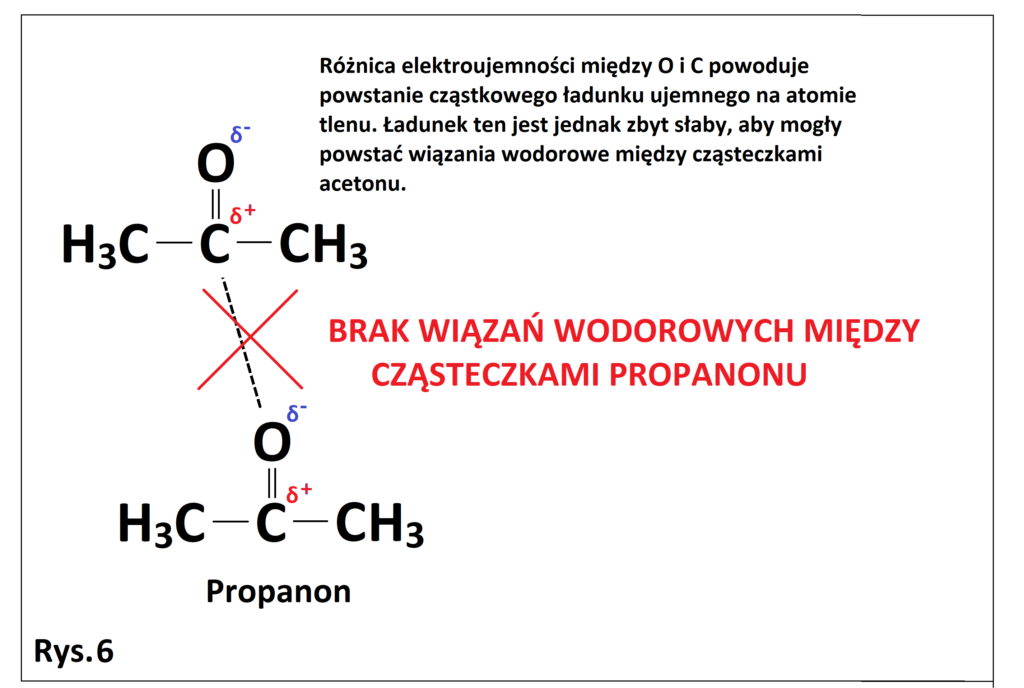
zbyt mały ładunek ujemny, aby mogło dojść do powstania wiązań wodorowych między cząsteczkami acetonu. Jednocześnie aceton może wytwarzać wiązania wodorowe z cząsteczkami wody, co można zaobserwować na poniższym rysunku (Rys. 7). Cząstkowy ładunek
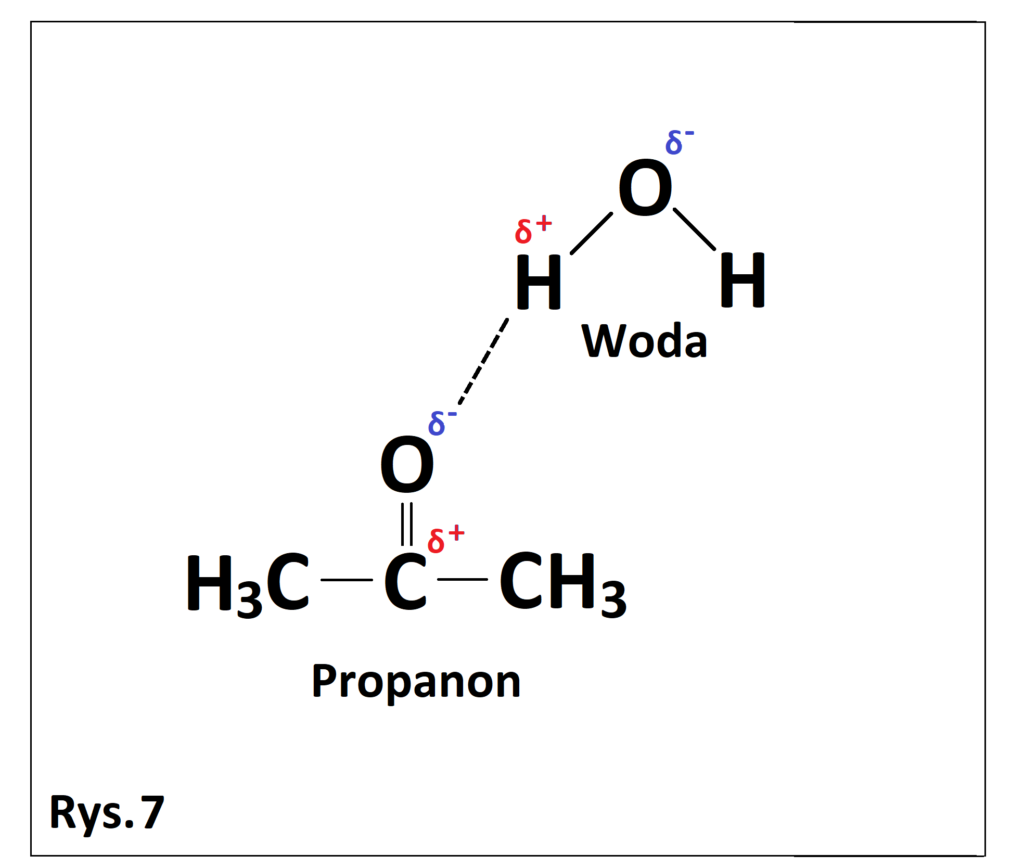
ujemny zgromadzony na atomie tlenu propanonu jest na tyle słaby, że aceton nie wytwarza wiązań wodorowych między własnymi cząsteczkami, ale na tyle duży, że może wytwarzać wiązania wodorowe z atomem wodoru cząsteczki wody, który obdarzony jest silnym cząstkowym ładunkiem dodatnim.
Reasumując związek chemiczny nie wytwarzający wiązań wodorowych między własnymi cząsteczkami może wytwarzać wiązania wodorowe, jeśli:
- posiada silnie elektroujemny atom z wolną parą elektronową (zazwyczaj O, N, F)
- znajduje się w mieszaninie ze związkiem mogącym wytwarzać wiązania wodorowe między własnymi cząsteczkami (posiadającym silnie elektroujemny pierwiastek z wolną parą elektronową połączony z atomem wodoru).
5. Wiązania wodorowe między cząsteczkami kwasów nieorganicznych.
Bardzo często “w internetach” uczniowie pytają, czy wiązania wodorowe istnieją w roztworach kwasów nieorganicznych. Weźmy na świecznik chociażby roztwór kwasu siarkowego (VI). Po przeanalizowaniu wzoru strukturalnego tego kwasu (Rys. 8) widzimy,
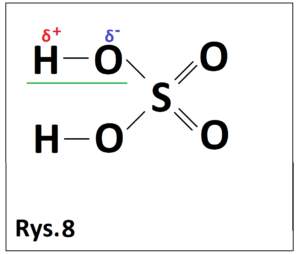
że istnieje ujemnie naładowany atom tlenu połączony bezpośrednio z atomem wodoru (fragment oznaczony zielonym kolorem), co oznaczałoby że między cząsteczkami kwasu siarkowego (VI) mogą powstawać wiązania wodorowe, co jest rzeczywiście prawdą, ale należy jednocześnie zaznaczyć, że wiązania te mogą powstać jedynie wtedy, gdy cząsteczki kwasu siarkowego (VI) występują w postaci niezdysocjowanej (tylko wtedy atom tlenu połączony jest z atomem wodoru). Wiedząc, że stopień dysocjacji zależy odwrotnie proporcjonalnie od stężenia, można powiedzieć, że tylko w bardzo stężonym roztworze H2SO4 będą istniały wiązania wodorowe między cząsteczkami tego kwasu, bo tylko w takich warunkach w roztworze tego kwasu będą znajdowały się cząsteczki niezdysocjowane. Reasumując, wiązania wodorowe mogą istnieć w roztworach kwasów nieorganicznych, ale tylko wtedy, gdy cząsteczki te występują w postaci niezdysocjowanej (stężone roztwory mocnych kwasów oraz roztwory słabych kwasów).
6. Wiązania wodorowe w przypadku innych pierwiastków niż N, O, F.
W wielu licealnych podręcznikach podkreśla się fakt, że wiązanie wodorowe powstaje gdy obecny jest jeden z trzech wymienionych powyżej pierwiastków. Podobnie jednak jak świat nie jest czarno-biały, tak samo procesy analizowane z punktu widzenia chemii nie są zero-jedynkowe. Azot, tlen i fluor wytwarzają wiązania wodorowe gdyż posiada najwyższą elektroujemność w układzie okresowym, stąd cząstkowy ładunek ujemny na nich zgromadzony jest stosunkowo większy w porównaniu do innych pierwiastków. Nie zmienia to jednak faktu, że takie pierwiastki jak: chlor, siarka czy brom dysponują również stosunkowo wysoką elektroujemnością oraz posiadają wolną parę elektronową, czyli spełniają warunki potrzebne do wytwarzania wiązań wodorowych. Co więc z nimi?
W roztworze wodnym kwasu siarkowodorowego jak najbardziej mogą występować wiązania wodorowe, są one jednak pomijalnie słabe z uwagi na fakt, że siarka posiada stosunkowo niską elektroujemność oraz z uwagi na rozmiar atomu siarki (większy rozmiar atomu utrudnia tworzenie wiązań wodorowych). Tak więc można powiedzieć, że w roztworze H2S istnieją wiązania wodorowe, tylko że są pomijalnie słabe i nie wpływają przez to w znaczący sposób na właściwości fizyczne tego związku.
Tak więc inne pierwiastki (poza N, O, F), posiadające cząstkowy ładunek ujemny również mogą wytwarzać wiązania wodorowe, są one jednak bardzo słabe i z praktycznego punktu widzenia pomijalne.
7. Wpływ rzędowości amin i amidów na możliwość wytwarzania międzycząsteczkowych wiązań wodorowych.
Wiedząc jakie są warunki konieczne do wytworzenia wiązań wodorowych między własnymi cząsteczkami (punkt 3), pytanie czy wszystkie aminy mogą wytwarzać wiązania wodorowe między własnymi cząsteczkami? Spójrzmy na poniższy rysunek (Rys. 9).
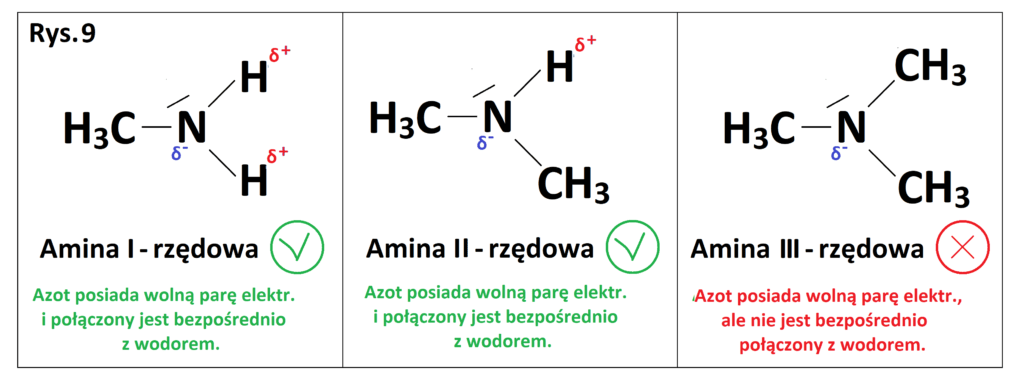
Widzimy, że aminy I i II -rzędowe mogą wytwarzać wiązania wodorowe między własnymi cząsteczkami z uwagi na obecność elektroujemnie naładowanego atomu azotu z wolną parą elektronową, który połączony jest bezpośrednio z atomem wodoru. Z kolei aminy III-rzędowe nie mogą wytwarzać wiązań wodorowych między własnymi cząsteczkami (brak bezpośredniego połączenia z wodorem), mogą jednak wytwarzać chociażby wiązania wodorowe z innymi cząsteczkami, np.: woda, etanol.
Podobnie można przeanalizować sytuację w amidach (Rys. 10).
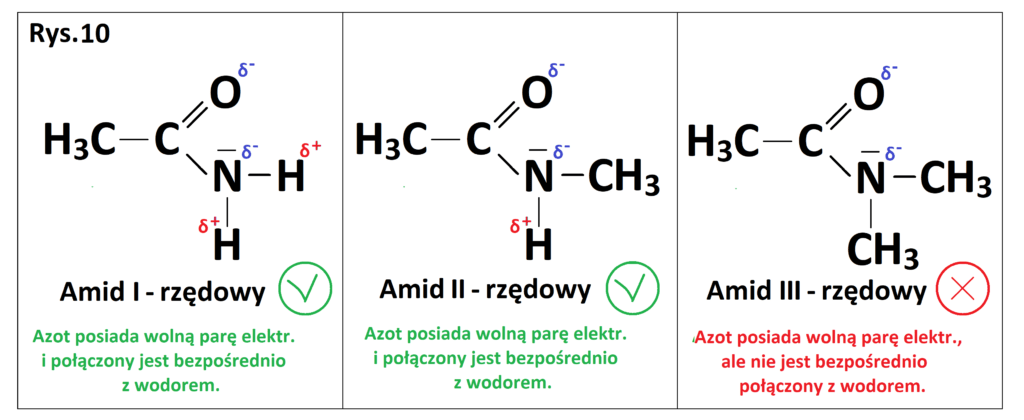
Sytuacja wygląda tutaj analogicznie jak w przypadku amin. Warto zaznaczyć, że amid III-rzędowy nie może wytwarzać wiązań wodorowych między własnymi cząsteczkami, może jednak wytwarzać wiązania wodorowe z innymi cząsteczkami (woda, alkohole) zarówno poprzez azot naładowany ujemnie jak i tlen w grupie karbonylowej.
Pozdrawiam.
Łukasz Lijewski – AKADEMIA CHEMII
Wszelkie prawa zastrzeżone!!!
Zamieszczanie jakichkolwiek fragmentów tego artykułu w innych publikacjach i stronach internetowych bez zgody autora jest zabronione.