O ile większość licealistów kojarzy w miarę dobrze teorię Brónsteda-Lowry’ego, to teoria Lewisa dla wielu pozostaje ciągle „czarną magią”. Wynika to głównie z faktu, że wśród zadań maturalnych pojawia się rzadziej, a co za tym idzie w szkołach tłumaczona jest w sposób wybiórczy. Jednakże jej zrozumienie jest kluczowe, jeżeli maturzysta, pasjonat chce zrozumieć chemię.
1. Kwasy i zasady Lewisa – omówienie
Jak dobrze wiemy, w teorii Brónsteda analizujemy kto jest protonodawcą (kwas), a kto protonobiorcą (zasada). Natomiast w teorii Lewisa skupiamy się na czymś zupełnie innym, czyli tym, kto komu oddaje pary elektronowe.
Zasadą Lewisa nazwiemy związek i drobinę, która jest dawcą pary elektronowej, czyli odwrotnie niż w Brónstedzie. Skoro taka zasada Lewisa ma oddawać pary elektronowe, to musi zawierać w sobie pierwiastek posiadający wolne pary elektronowe (tak więc np. N, O, F). Zasada Lewisa posiada zazwyczaj nadmiar elektronów (skoro chce je komuś przekazywać), tak więc często zasadami Lewisa będą aniony: Cl–, OH–, F–, albo cząsteczki posiadające wolne pary elektronowe: NH3, H2O.
Kwas Lewisa to z kolei drobina, która jest akceptorem (biorcą) par elektronowych. Będzie to więc struktura, która posiada niedobór elektronów, a więc będąca kationem (np. H+), lub związek zawierający pierwiastek z pechowej 13-stki (np. Al, B, Ga). Dlaczego grupa XIII jest pechowa? Zapraszam do dalszej części artykułu, aby to zrozumieć. Warto zaznaczyć, że kwas Lewisa musi posiadać wolny orbital, aby móc nazywać się kwasem.
W wyniku reakcji kwasu i zasady Lewisa powstaje tzw addukt kwasowo-zasadowy. Czym jest owy addukt wyjaśniam w dalszej części artykułu.
Przejdźmy do omówienia jakichś konkretnych przykładów.
2. Teoria Lewisa – przykłady
- Najczęściej powtarzanym przykładem wyjaśniającym teorię Lewisa jest chyba reakcja cząsteczki BH3 z NH3. Reakcję tą przedstawiam od razu w zapisie strukturalnym.
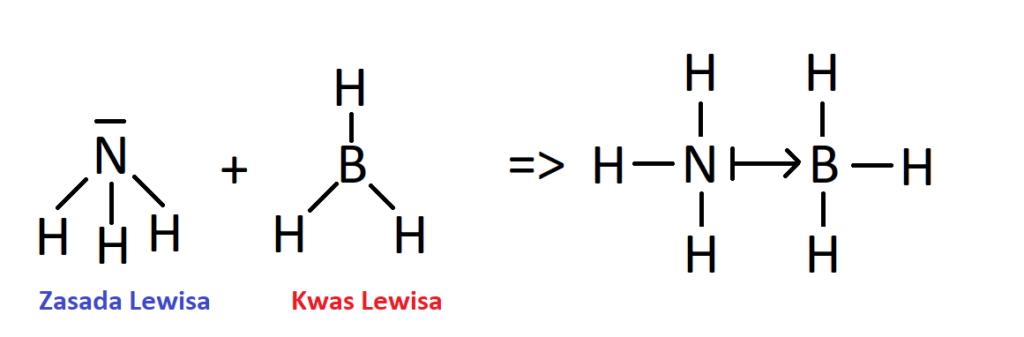
Amoniak z uwagi na obecność wolnej pary na azocie pełni funkcję zasady Lewisa przekazując wolną parę atomowi boru z cząsteczki BH3, która jest kwasem Lewisa. Widać to dokładnie w produktach reakcji, gdzie powstaje tzw addukt kwasowo-zasadowy, ale o tym później.
- Kolejnym przykładem może być reakcja cząsteczki BF3 z F– przebiegająca wg równania:
BF3 + F– => BF4–
Aby lepiej przeanalizować tę reakcję spójrzmy na poniższy zapis w formie strukturalnej:
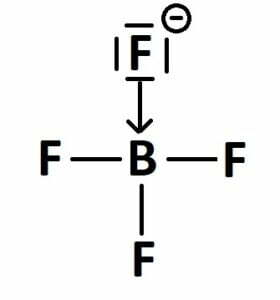
Bardzo dobrze widać, że anion fluorkowy pełni w tej reakcji rolę zasady, przekazując jedną ze swoich wolnych par w wiązaniu koordynacyjnym atomowi boru, który pełni funkcję kwasu, gdyż przyjmuje tą wolną parę. Na rysunku widać również, że bor przyjmuje po reakcji ładunek ujemny, gdyż posiada więcej elektronów w stosunku do swojej postaci „normalnej”, w wyniku przyłączenia pary elektronowej od jonu F–
3. Addukty kwasowo-zasadowe
W wyniku reakcji kwasu Lewisa (K) i zasady Lewisa (Z) powstaje tzw addukt kwasowo-zasadowy, co pokazuje poniższy rysunek:

Skoro więc produkt reakcji jest swego rodzaju połączeniem kwasu i zasady, czyli adduktem oraz wiedząc, że kwasami Lewisa są związki posiadające wolny orbital, pytanie brzmi: „Czy można wg teorii Lewisa opisać reakcję dla związków, które nie posiadają wolnych orbitali, czyli innymi słowy – są na starcie adduktami?”. Oczywiście, że można:
- Jednym z prostszych przykładów takiej reakcji jest reakcja amoniaku z wodą, inaczej dysocjacja wodorotlenku amonu
Reakcja ta przebiega w następujący sposób:
NH3 + H2O <=> NH4+ + OH–
Z przedstawionego u góry zapisu nie widać jednak zbyt klarownie kto komu oddaje parę elektronową. Jednak do określenia kto jest kwasem, a kto zasadą Lewisa wystarczy czasami spojrzeć jedynie na ładunki molekuł przed i po reakcją.
Cząsteczka NH3 po reakcji przekształca się w kation NH4+. Skoro więc po reakcji ma ładunek „+”, a przed reakcją była obojętną cząsteczką, to musiała w tej reakcji oddać elektrony, czyli jest zasadą Lewisa.
Gorzej jednak opisać rolę wody w tym procesie. Spójrzmy pierw na zapis owego równanie w formie bardziej strukturalnej:

Na powyższym rysunku widać dokładnie, że amoniak jest w tej reakcji dawcą pary elektronowej. Pełni więc funkcję zasady Lewisa. Jednak sama z siebie, woda nie stanowi kwasu Lewisa w stricte tego słowa znaczeniu. Ową wolną parę elektronową amoniaku przyjmuje jon H+ pochodzący z wody. Tak więc woda jest adduktem kwasowo-zasadowym i pierw należałoby ją rozbić na jony wg następującego równania:
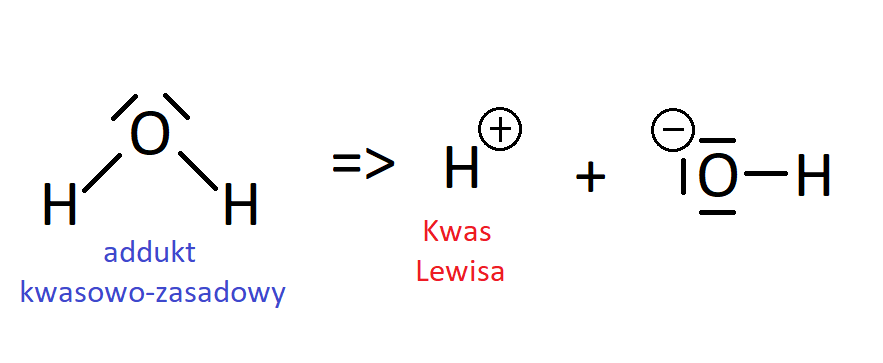
Dopiero powstający z rozbicia wody jon H+ można nazwać kwasem Lewisa, ponieważ posiada on wolny orbital oraz co widać z równania wcześniejszego to właśnie on przyjmuje parę elektronową. Warto też zaznaczyć, że w powstałym jonie NH4+ na atomie azotu zgromadzony jest ładunek „+”, ponieważ z formalnego punktu widzenia azot tworząc wiązanie koordynacyjne przekazuje on jonowi H+ swoją parę elektronową (pożycza ją).
- Reakcja autodysocjacji wody:
H2O + H2O <=> H3O+ + OH–
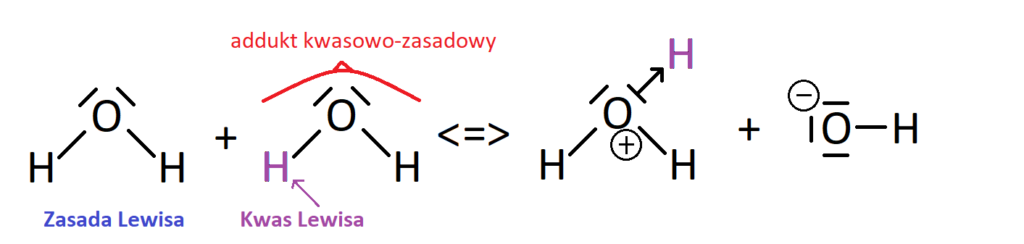
O samym procesie autodysocjacji napiszę w innym artykule. Spójrzmy na powyższe równanie reakcji. Cząsteczka wody po lewej stronie jest zasadą Lewisa, ponieważ przekazuje wodorowi z drugiej cząsteczki (oznaczonemu jako fioletowy) swoją wolną parę elektronową.
Z kolei kwasem Lewisa jest jon H+ pochodzący z wody, którą znowu można nazwać adduktem kwasowo-zasadowym. Proces autodysocjacji przebiega bardzo słabo, gdyż stała dysocjacji tej reakcji wynosi 1,8*10-16. W powstałym katonie hydroniowym (H3O+) na tlenie zgromadzony jest ładunek dodatni, ponieważ tlen przekazując jonowi H+ swoją parę elektronową – traci ją z formalnego punktu widzenia i w porównaniu do swojej normalnej konfiguracji, ma niedobór elektronów.
Adduktami mogą być różne związki chemiczne. Warto wiedzieć, że wszystkie kwasy są adduktami kwasowo-zasadowymi.
3. Porównanie teorii kwasów i zasad Lewisa i Brónsteda-Lowry’ego
Dobrym równaniem pozwalającym pokazać powiązanie między tymi dwoma teoriami jest reakcja metyloaminy z wodą, inaczej mówiąc jej dysocjacja:
CH3NH2 + H2O <=> CH3NH3+ + OH–
Zgodnie z teorią Brónsteda-Lowry’ego:
CH3NH2 jest zasadą, gdyż przyłącza proton zamieniając się w kation CH3NH3+.
H2O jest kwasem, gdyż oddaje proton przekształcając się w anion OH–.
Teraz spójrzmy na zapis tego równania w postaci strukturalnej:
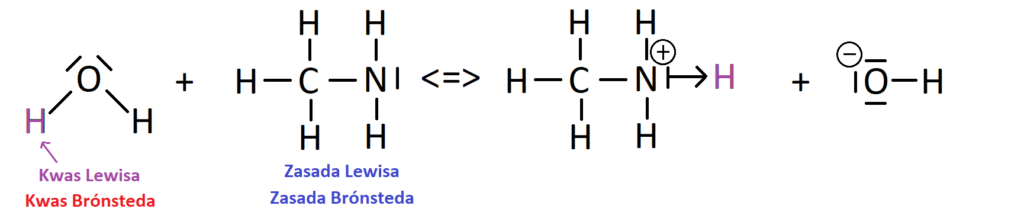
Na powyższym równaniu bardzo dokładnie widać, że atom azotu z aminy przekazuje swoją wolną parę elektronową kationowi H+ odłączonemu od cząsteczki wody. Pełni więc funkcję zasady Lewisa. Z kolei woda jest po raz kolejny adduktem kwasowo-zasadowym, a rolę kwasu Lewisa pełni jon H+ z niej pochodzący. Widzimy, że ładunek dodatni po reakcji zgromadzony jest na azocie, ponieważ jako dawca wolnej pary formalnie ją traci, co powoduje, że obdarzony jest ładunkiem dodatnim.
Tak więc teoria Lewisa i Brónsteda-Lowry’ego w tym przypadku pokrywają się ze sobą, jednakże nie zawsze tak się dzieje i należy o tym pamiętać.
4. Pechowa 13-stka układu okresowego, czyli czego pragnie Bor i Glin.
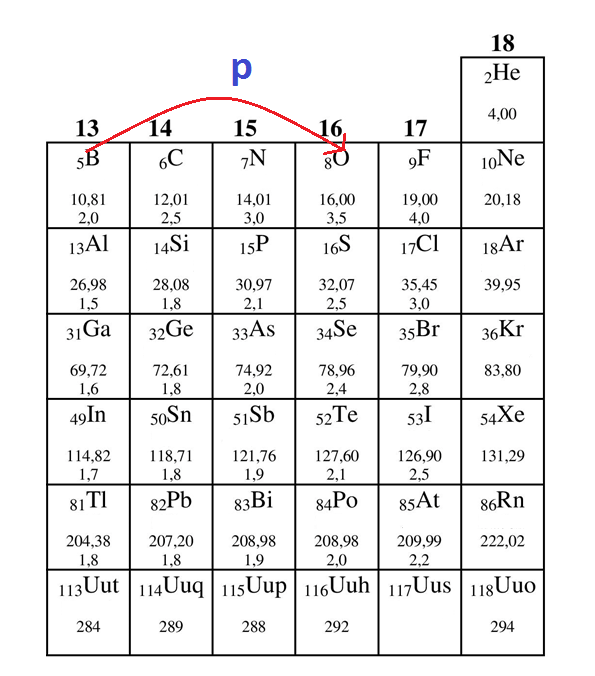
Jeżeli popatrzymy na równania reakcji, które opisują teorię Lewisa, to zauważymy że bardzo często pojawiają się tam związki chemiczne zawierające pierwiastki grupy 13 układu okresowego, tj: B, Al, Ga. Nazwałem tę grupę nie bez powodu pechową, ponieważ jest to grupa, dla której pierwiastki nie wiedzą w którą stronę układu okresowego podążać w drodze do oktetu. Dla przykładu, przeanalizujmy budowę cząsteczki BH3.

Atom boru wytwarza 3 wiązania kowalencyjne, po wytworzeniu których przyjmuje konfigurację elektronową – nie gazu szlachetnego (neonu), a atomu tlenu, co pokazuje rysunek obok. Inaczej mówiąc bor nie spełnia reguły oktetu, na czym bardzo zależy każdemu pierwiastkowi.
Dla porównania:
- Węgiel (i inne pierwiastki tej grupy) może wytwarzać 4 wiązania i osiąga wtedy konfigurację neonu,
- azot (i inne pierwiastki tej grupy) wytwarza 3 wiązania i osiąga wtedy konfigurację neonu,
- tlen (i inne pierwiastki tej grupy) wytwarza 2 wiązania i osiąga konfigurację neonu.
Niemetale te w przeciwieństwie do pierwiastków grupy XIII osiągają więc za pomocą wiązań kowalencyjnych konfigurację gazów szlachetnych. Podobnie jest z pierwiastkami I i II grupy układu okresowego. Dla przykładu:
- sód (i inne pierwiastki tej grupy) oddaje 1 elektron tworząc wiązanie jonowe i osiąga konfigurację neonu
- magnez (i inne pierwiastki tej grupy) oddaje 2 elektrony tworząc wiązania jonowe i osiąga konfigurację neonu
Grupa 13 jest więc jedyną grupą (wspomnianą pechową 13-stką), która nie osiąga oktetu za pomocą standardowych wiązań kowalencyjnych. Co więc robią pierwiastki grupy XIII? Ano chętnie pełnią rolę kwasów Lewisa i przyjmują od innych pierwiastków wolne pary elektronowe. Dlaczego? Spójrzmy na poniższą reakcję, a wszystko stanie się jasne.
- Dla przykładu przeanalizujmy reakcję wytwarzania AlCl4– w reakcji AlCl3 z CH3Cl, czyli pierwszy etap reakcji alkilowania związków aromatycznych:
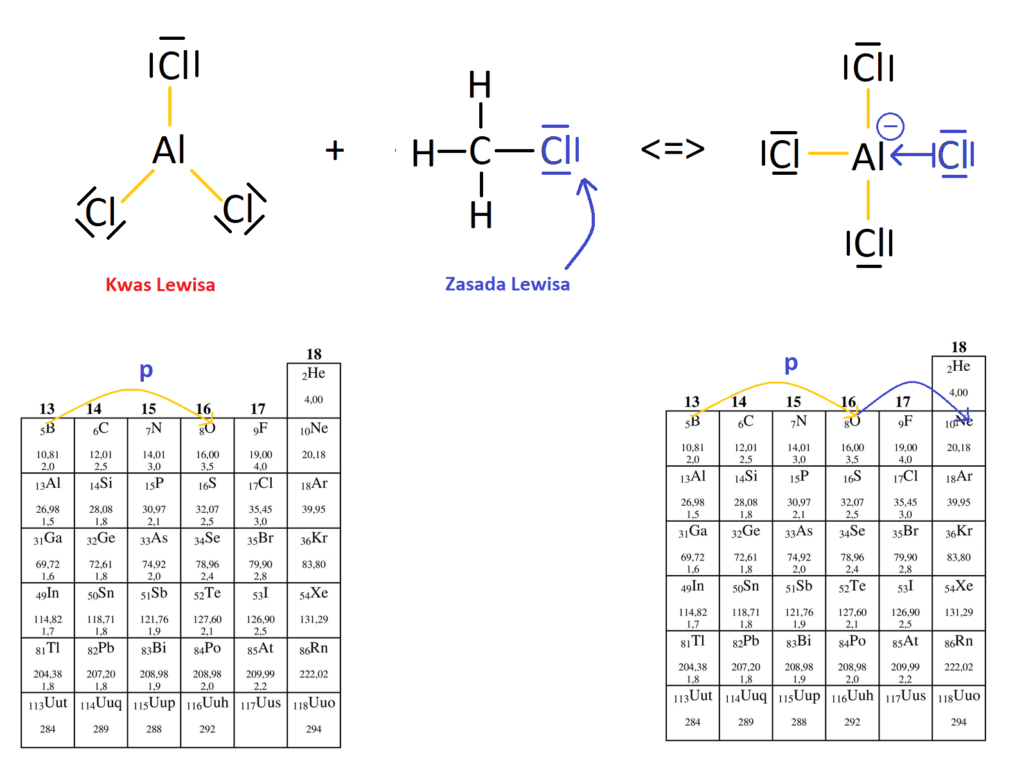
Jak widać na powyższej reakcji atom chloru pochodzący z chlorometanu (będącego adduktem kwasowo-zasadowym) jest zasadą Lewisa i przekazuje swoją wolną parę atomowi glinu z AlCl3, który jest kwasem Lewisa. Atom glinu w cząsteczce AlCl3 przed reakcją z chlorometanem osiągał konfigurację elektronową atomu tlenu, co pokazuje lewa strona powyższego rysunku (żółte wiązania kowalencyjne na rysunku i żółta strzałka na układzie okresowym). Dopiero po wytworzeniu wiązania koordynacyjnego, atom glinu dostaje dodatkową parę elektronową, dzięki czemu może spełnić regułę oktetu (niebieskie wiązanie koordynacyjne po prawej stronie rysunku oraz niebieska strzałka na układzie okresowym). TAK WIĘC PIERWIASTKI GRUPY XIII PEŁNIĄ FUNKCJĘ KWASÓW LEWISA PO TO, ABY MÓC OSIĄGNĄĆ KONFIGURACJĘ GAZÓW SZLACHETNYCH I SPEŁNIĆ REGUŁĘ OKTETU I DUBLETU.
A wisienką na torcie może być pytanie: „Jaką rolę w reakcji z wodą pełni kwas borowy?”
Wydawałoby się, że reaguje on z wodą wg następującego równania reakcji:
H3BO3 + H2O <=> H2BO3– + H3O+
Jednak wiemy, że bor jako pierwiastek 13 grupy lubi przyjmować pary elektronowe. Tak więc naprawdę ta reakcja przebiega zgoła inaczej. Kwas borowy reaguje z wodą w następującym równaniu reakcji:
H3BO3 + 2H2O <=> [B(OH)4]– + H3O+
Spójrzmy może na te równanie zapisane w postaci strukturalnej:

Kwas borowy (kwas Lewisa 1) jako że lubi bardzo elektrony, pobiera wolną parę od jonu OH- (zasady Lewisa 1) powstającego z rozpadu adduktu kwasowo-zasadowego. Jednocześnie powstały z rozpadu jon H+ (kwas Lewisa 2), pobiera elektron od cząsteczki wody (zasady Lewisa 2). Wskutek reakcji powstaje anion tetrahydroksyboranowy, w którym bor osiąga dzięki przyjęciu dodatkowej wolnej pary – konfigurację gazu szlachetnego, czyli neonu. Widać więc jak bardzo ważne jest zrozumienie teorii Lewisa w kwestii zrozumienia reakcji borowców i ich związków.
Reasumując:
- Teoria Lewisa i Teoria Brónsteda-Lowry’ego zazwyczaj się ze sobą pokrywają (ale oczywiście nie zawsze)
- Kwasami Lewisa są b.często pierwiastki grupy XIII, które dzięki uzyskaniu wolnej pary innego pierwiastka mogą osiągnąć konfigurację gazu szlachetnego i spełnić regułę oktetu.
- Bardzo często nie można analizować kwasów Lewisa w sposób bezpośredni, jeżeli mamy do czynienia z tzw. adduktami kwasowo-zasadowymi. W takich przypadkach kwasami są jony dodatnie powstające z rozpadu adduktu.
Pozdrawiam.
Łukasz Lijewski – AKADEMIA CHEMII
Wszelkie prawa zastrzeżone!!!
Zamieszczanie jakichkolwiek fragmentów tego artykułu w innych publikacjach i stronach internetowych bez zgody autora jest zabronione.