Krótka historia o tym jak wyznaczać stopnie utlenienia w związkach organicznych zawierających azot oraz inne pierwiastki bardziej elektroujemne od węgla.
Należy zrozumieć, że stopień utlenienia to tylko hipotetyczny ładunek jaki miałby dany atom gdyby wszystkie wiązania miały charakter jonowy. Oczywiście nie wszystkie wiązania mają charakter jonowy, ale my dla uproszczenia zakładamy, że jeżeli jakiś atom (powiedzmy X) ma wyższa elektroujemność od atomu Y, to zabierze mu elektron i w rezultacie X naładuje się ujemnie: -I stopień utlenienia.

Z kolei Y odda elektron i przyjmie + I stopień utlenienia. Czerwone cyfry na rysunku oznaczają hipotetycznie przyjętą przeze mnie elektroujemność, a niebieskie stopień utlenienia.
Jeżeli w związku pojawia się pierwiastek bardziej elektroujemny od węgla, ale inny niż tlen, to robi się wielki bałagan. Pokażę na żywych przykładach jak rozważać takie przypadki, a wszystko stanie się jasne. Użyjemy metody tzw „wojny pierwiastków” – tak, sam wymyśliłem tę nazwę.
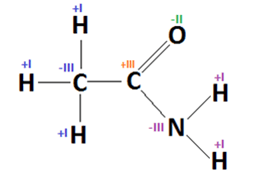
- Przykład 1: cząsteczka nitrometanu, czyli CH3NO2.
Poniższy rysunek przedstawia wzór strukturalny tego związku. Na czerwono oznaczono elektroujemności poszczególnych pierwiastków. Na początku rozważmy połączenia C-H.

Węgiel ma wyższą elektroujemność od wodoru, tak więc po założeniu że jest to wiązanie jonowe, węgiel zyskuje elektron (ładunek –I) od trzech wodorów (bo od każdego zabiera po jednym elektronie). Z kolei każdy wodór zyskuje ładunek + I gdyż „oddał” elektron węglowi. Możemy to zaobserwować na kolejnym rysunku. Inaczej mówiąc węgiel stoczył walkę z wodorami, a z uwagi że z każdym wygrał – zyskuje ładunek –III.

Idźmy jednak do kolejnych pojedynków, bo możemy analizować obliczanie stopni utlenienia jako pojedynki poszczególnych pierwiastków o elektrony. Teraz walczy węgiel z azotem, a że azot ma elektroujemność większą to zabiera jeden elektron węglowi i ładuje się na –I. Z kolei węgiel oddaje jeden elektron azotowi i nie ma już ładunku –III, tylko –II (bo oddał jeden elektron azotowi). Można to prześledzić na rysunku poniżej.

Na koniec pozostaje nam walka azotu z dwoma tlenami. Azot ma niższą elektroujemność od tlenu, tak więc przegrywa walkę z obydwoma tlenami (dla uproszczenia i łatwiejszej analizy na rysunku namalowałem wiązania podwójne, chociaż jak dobrze wiecie, jedno z nich powinno być koordynacyjne). Tak więc jeden tlen zabiera dwa elektrony od azotu (z uwagi na to, że jest to wiązanie podwójne) oraz drugi tlen również zabiera dwa elektrony od azotu. Ostatecznie każdy tlen zyskuje ładunek –II, natomiast azot nie ma już ładunku –I, tylko +III (ponieważ oddał 4 elektrony tlenom), co pokazuje poniższy – ostateczny rysunek.

- Przykład 2: cząsteczka aniliny, inaczej aminobenzenu. Poniżej rysunek strukturalny tego związku.

W tym przypadku będziemy rozpatrywać jedynie pierwiastki przy których podałem wartości elektroujemności. Resztę na pewno każdy przeanalizuje metodą „segmentów węglowych”, której uczą w szkołach. Na początku wiązanie N-C. Azot ma większą elektroujemność od węgla, stąd zabiera mu elektron i ładuje się na –I, natomiast węgiel po oddaniu elektronu ładuje się na +I. Poniżej rysunek dla unaocznienia.

Pozostaje do stoczenia walka między azotem, a wodorami. Azot ma większą elektroujemność, stąd od obydwóch wodorów zabiera po jednym elektronie i ładuje się ostatecznie na –III (dostał dwa dodatkowe elektrony od wodorów). Natomiast wodory skoro oddały po jednym elektronie, to ładują się na +I.

- Przykład 3: cząsteczka etanoamidu. Wzór poniżej:

Zacznijmy od węgla z grupy CH3. Jako, że ma elektrouejmność większą od wodorów – zabiera od każdego z nich po jednym elekronie uzyskując ładunek –III, natomiast wodory uzyskują w rezultacie ładunek +I.

Następnie przechodzimy do wiązania C-C. Węgle nie walczą ze sobą, bo mają taką samą elektroujemność. Możemy więc pominąć te wiązanie. Przechodzimy do wiązania C=O. Tlen ma większą elektroujemność od węgla, a że wytwarza z nim wiązanie podwójne to zabiera mu 2 elektrony i ładuje się do –II stopnia. Z kolei węgiel ładuje się do +II stopnia.

Teraz przechodzimy do wiązania C-N. Azot ma elektroujemność większą od węgla, więc zabiera mu jeden elektron i ładuje się do –I stopnia. Z kolei węgiel oddaje 1 elektron azotowi i ostatecznie uzyskuje +III stopień.

Na koniec pozostaje rozstrzygnąć wiązania N-H i będziemy mieli ustalone stopnie utlenienia. Azot ma większą elektroujemność od obydwóch wodorów, stąd od każdego zabiera po 1 elektronie i ładuje się ostatecznie na –III stopień (należy dodać dwa elektrony do już wcześniej uzyskanego –I stopnia utlenienia). Z kolei jak to zazwyczaj bywa, wodory ładują się do +I stopnia utlenienia.
Analizując różnice elektroujemności między poszczególnymi pierwiastkami i „tocząc między nimi „bitwy” po kolei, możemy rozstrzygnąć stopnie utlenienia w każdym przypadku. Chciałbym przy okazji pokazać, dlaczego wodór w wodorkach jonowych przyjmuje –I stopień utlenienia, co stanowi pewnego rodzaju wyjątek dla tego atomu.
- Przykład 4: cząsteczka wodorku sodu.

O ile wodór zazwyczaj ma elektroujemność niższą od pierwiastków z którymi jest połączony, to w wodorkach jonowych (pochodzących od metali I i II grupy) wodór ma wyższą elektroujemność. W wyniku tego wodór wygrywa walkę z sodem, zabiera ma elektron i ładuje się na –I stopień. Z kolei sód oddaje elektron i ładuje się na +I stopień utlenienia.

Tak więc wcale nie trzeba się uczyć wyjątków dotyczących stopni utlenienia. Jeżeli każdy przykład będziemy rozwiązywali zaprezentowaną metodą, to zawsze dojdziemy do rzeczywistego wyniku. Wszystko ma swoją logiczną argumentację.
- Przykład 5: cząsteczka octanu etylu.
Poniżej przedstawiony jest wzór estru – octanu etylu:

W ugrupowaniu CH3 od lewej jest tak jak w poprzednich przykładach. Węgiel zyskuje –III stopień utlenienia, natomiast wodory +I. Następnie omijamy wiązanie C-C ponieważ różnica elektroujemności wynosi 0 i przechodzimy do wiązania C=O.

Tlen ma wyższą elektroujemność od węgla, a że połączone są wiązaniem podwójnym, to tlen zabiera mu 2 elektrony i przyjmuje ładunek –II, natomiast węgiel przyjmuje ładunek +II.

Przechodzimy do dwóch wiązań C-O. Tlen ma wyższą elektroujemność, więc zabiera jeden elektron od jednego węgla i drugi elektron od drugiego węgla (z każdym jest polączony wiązaniem pojedynczym). W rezultacie przyjmuje stopień –II, a węgiel po lewej nie ma już stopnia +II, tylko +III. Z kolei węgiel po prawej po oddaniu elektronu przyjmuje ładunek +I.

Na końcu należy uwzględnić, że węgle mają elektroujemności większe od wodorów, stąd węgiel z grupy CH2 przyjmie ostatecznie stopień –I (przyjmie dwa elektrony, a miał wcześniej +I stopień), natomiast węgiel z grupy CH3 będzie miał ostatecznie –III stopień.

To by było na tyle. Jeżeli będziecie mieli jakieś ciekawe przykłady do omówienia, to piszcie w komentarzach. Postaram się wtedy dopisać taką cząsteczkę.
Pozdrawiam,
Łukasz Lijewski – AKADEMIA CHEMII
Wszelkie prawa zastrzeżone!!!
Zamieszczanie jakichkolwiek fragmentów tego artykułu w innych publikacjach i stronach internetowych bez zgody autora jest zabronione.


