1. Reguła Markownikowa – definicja
Regułę Markownikowa stosuje się podczas addycji niesymetrycznych cząsteczek do alkenów i alkinów. Jest ona dość istotna w aspekcie matury, ponieważ w miarę często w arkuszach można spotkać zadania z nią związane. A brzmi ona następująco:
“Podczas addycji niesymetrycznych cząsteczek do wiązania pi, atom wodoru dołącza się do tego węgla C=, który połączony jest z większą liczbą atomów wodoru”
2. Przykłady
Zacznijmy od reakcji addycji chlorowodoru do cząsteczki propenu. Zapisujemy substraty tej reakcji:
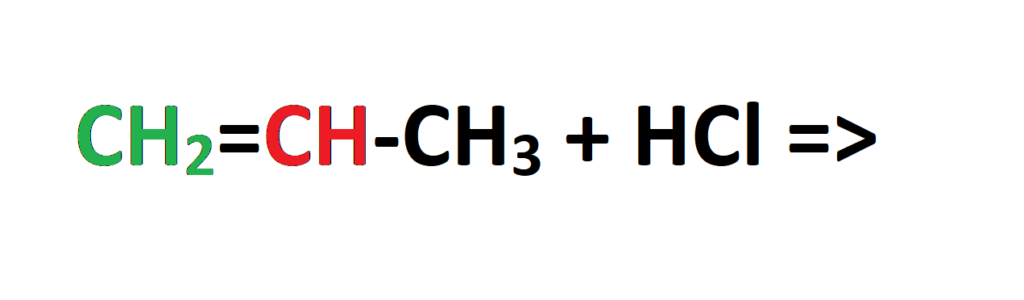
Jeżeli popatrzymy na cząsteczkę propenu, to widzimy, że mamy przy nim węgiel oznaczony na zielono, który jest połączony z dwoma wodorami oraz węgiel oznaczony na czerwono, który jest połączony z jednym wodorem. Zgodnie więc z regułą Markownikowa wodór z cząsteczki HCl dołączy się do węgla zielonego, który połączony jest z większą ilością wodorów. Popatrzmy na produkt główny reakcji:
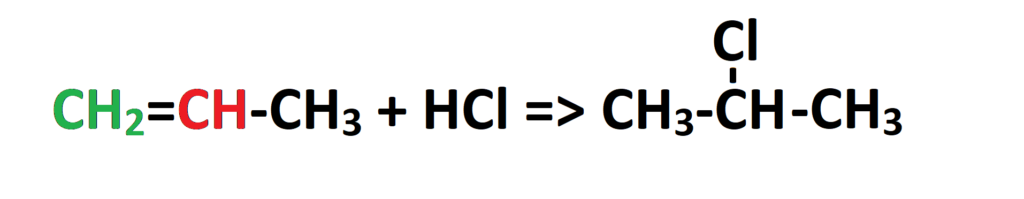
Jest to produkt główny reakcji. Oczywiście, nie oznacza to że drugi produkt reakcji (w którym to wodór dołącza się do węgla zawierającego mniejszą liczbę wodorów) nie powstaje. Owszem, powstaje ale w mniejszej ilości, czasami bliskiej 0%. Jeżeli jednak w zadaniu jest wyraźnie wskazane, że mamy podać produkt uboczny, tak jak w poniższym przykładzie, to musimy to zrobić. Przeanalizujmy reakcję addycji wody do but-1-enu:
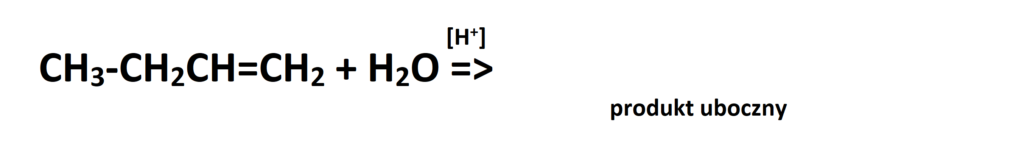
Tak więc w produkcie ubocznym wodór przyłączy się do tego węgla, który ma mniej wodorów, czyli drugiego od prawej strony. Przypominam, że w reakcjach typu addycja rozważamy tylko te węgle, które uczestniczą w tworzeniu wiązania podwójnego! A więc zapiszmy produkt uboczny tej przemiany:
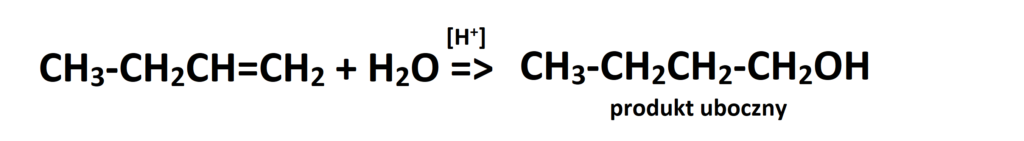
Dla porównania popatrzmy jeszcze na produkt główny reakcji addycji, czyli ten o którym mówi reguła Markownikowa:
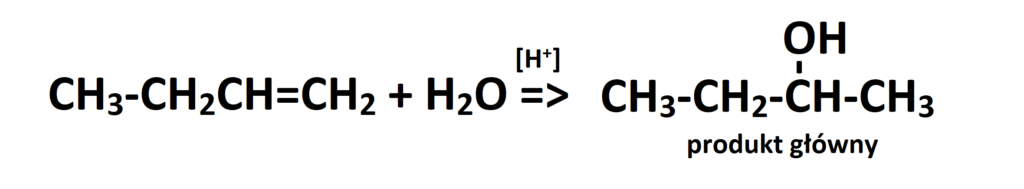
Pamiętajcie, że jeżeli w zadaniu nic nie jest napisane o produkcie ubocznym, to po prostu go nie rozważamy. Tak naprawdę, większość reakcji w chemii towarzyszy powstawanie różnych produktów ubocznych, jednak jeżeli mielibyśmy je wszystkie wypisywać, to byłoby to bardzo kłopotliwe i po prostu trudne. Dlatego też w większości przypadków, jeżeli jakiś produkt powstaje w małej ilości, to po prostu go ignorujemy.
I jeszcze jeden przykład na koniec. Możemy również rozważać reakcje addycji dla alkinów, pamiętając o tym, że do alkinów można przyłączyć dwukrotnie więcej cząsteczek. Dla przykładu, przeanalizujmy reakcję addycji 2 cząsteczek HBr do propynu:
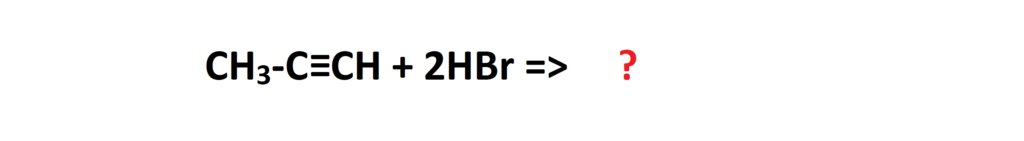
Wielu uczniów popełnia w takim przypadku błąd, zapominając o regule Markownikowa i dołączając podstawniki wg własnego uznania. Aby nie popełnić tutaj błędu, przeanalizujmy 2-etapowo tę reakcję. Na początku dołączmy jedną cząsteczkę HBr:
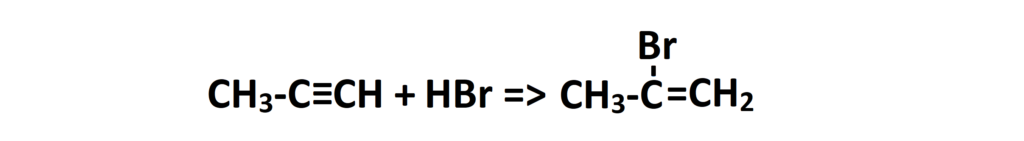
Widzimy, że pękło nam wiązanie potrójne i wodór przyłączył się do węgla zawierającego więcej wodorów. Jednocześnie jednak mamy jeszcze wiązanie podwójne, które rozbijemy dopiero 2 etapie. Zobaczmy:

Tak więc kluczem do przewidzenia prawidłowego produktu było tutaj rozbicie tej reakcji na 2 etapy.