Tym razem pokażę Wam najkrótszy sposób przypisywania hybrydyzacji i rysowania wzorów elektronowych jaki znam. Sam go praktykuję od paru lat i jestem jego zagorzałym zwolennikiem. Daj się namówić i Ty a zobaczysz, że warto. Aby narysować wzór związku i określić jego hybrydyzację musimy wykonać 3 rzeczy.
Hybrydyzacja – Wstęp
Określanie ilości wiązań dla danego atomu. W tym celu patrzymy na układ okresowy, bo z niego da się wiele odczytać, a w kwestii budowy atomu to już w ogóle jest to skarbnica wiedzy. Weź do ręki układ okresowy i zaczynamy. Patrzymy na 1 grupę i przemieszczamy się po kolei:
- Pierwiastki 1 grupy (H, Li, Na, itd.) mogą wytwarzać jedno wiązanie i basta, bo mają tylko 1 elektron walencyjny.
- Pierwiastki II grupy (Be, Mg, Ca, itd.) mogą wytwarzać dwa wiązania, bo mają dwa elektrony walencyjne.
- Blok d pomijamy bo tutaj różnie bywa, ale najczęściej pierwiastki te wytwarzają 2 wiązania (są II-wartościowe), bo najtrwalsze ich jony powstają po oderwaniu walencyjnej powłoki s, która zawsze ma 2 elektrony).
- Pierwiastki grupy XIII (B, Al, Ga) mogą wytwarzać trzy wiązania, bo mają trzy elektrony walencyjne.
- Pierwiastki grupy XIV (C, Si, Ge) mogą wytwarzać cztery wiązania, bo mają cztery elektrony walencyjne. W tej grupie pojawia się po raz pierwszy w tych rozważaniach sytuacja, że pierwiastek spełni regułę oktetu, bo dostając od kogoś 4 elektrony, węgiel dla przykładu staje się neonem.
- Pierwiastki grupy XV (N, P, As) są również szczęśliwcami. Otóż im do oktetu potrzebne są tylko 3 elektrony, więc wytwarzają trzy wiązania kowalencyjne. Ale uwaga, pierwiastki te mają 5 elektronów, więc po wytworzeniu owych 3 wiązań, zostaną im 2 elektrony jako wolna para. Te elektrony będą mogły komuś pożyczyć, więc mogą wytworzyć 1 wiązanie koordynacyjne.
- Pierwiastki grupy XVI (O, S, Se) do oktetu potrzebują dwóch elektronów, więc mogą wytwarzać dwa wiązania kowalencyjne. Z uwagi na to, że mają 6 elektronów walencyjnych, to po wytworzeniu wiązań, zostaną im dwie wolne pary (4 el.), a więc mogą wytwarzać 2 wiązania koordynacyjne.
- Pierwiastki grupy XVII (F, Cl, Br) do oktetu potrzebują jednego elektronu, więc wytwarzają jedno wiązanie kowalencyjne, a że łącznie mają 7 elektronów walencyjnych, to po wytworzeniu wiązania kowalencyjnego, zostaną im trzy wolne pary (6 el.), a więc mogą wytwarzać dodatkowo 3 wiązania koordynacyjne.
- Wydaje się, że jest tu dużo do zapamiętania, ale jeżeli kilka razy patrząc jednocześnie na układ powtórzycie to sobie, to potem będziecie mogli w ciągu sekundy analizować ile i jakich wiązań wytwarza dana grupa. Spojrzycie na układ okresowy, popatrzycie ile brakuje pierwiastkowi elektronów do oktetu i ile ma łącznie elektronów walencyjnych i wszystko będziecie wiedzieć.
2. Metoda oceniania hybrydyzacji VSEPR skrócona do minimum.
Pobawmy się w liczenie punktów. Jeżeli:
- suma punktów wynosi 4 – przypisujemy hybrydyzację typu sp3
- suma punktów wynosi 3 – przypisujemy hybrydyzację typu sp2
- suma punktów wynosi 2 – przypisujemy hybrydyzację typu sp
Jaka jest zasada punktowania? Otóż wszystko ma jeden punkt. Tak więc:
- wiązanie kowalencyjne – przyznajemy 1 punkt
- wiązanie podwójne – przyznajemy 1 punkt
- wiązanie potrójne – przyznajemy 1 punkt
- wolna para elektronowa – przyznajemy 1 punkt
- wiązanie koordynacyjne – przyznajemy 1 punkt
3. Przechodzimy do rysowania wzorów elektronowych i określania hybrydyzacji. Połączmy razem to o czym przed chwilą napisałem. Do dzieła.
- Przykład: cząsteczka amoniaku – NH3
Azot jest w XV grupie, wytwarza więc 3 wiązania i ma 1 wolną parę. Malujemy na środku azot i wokół niego rozmieszczamy równo wodory tak, aby były umieszczone jak najdalej od siebie (Rys.a).
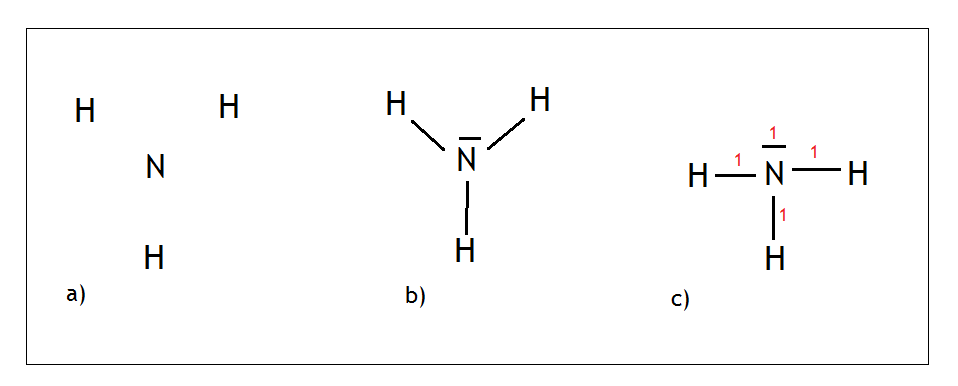
Azot wytwarza 3 wiązania kowalencyjne, a wodory po jednym wiązaniu. Jednocześnie zostaje nam 1 wolna para którą również malujemy (Rys. b).
Następnie oddalamy od siebie tak pierwiastki i wolną parę, żeby były jak najdalej. Na końcu liczymy sumę punktów o której mówiłem przed chwilą (czerwone cyferki na Rys, c) i skoro dla amoniaku wychodzi suma punktów 4, to mamy hybrydyzację typu sp3
- Przykład: cząsteczka dwutlenku węgla – CO2
Węgiel jako pierwiastek XIV grupy może wytwarzać 4 wiązania i nie ma wolnych par. Malujemy na środku węgiel, wokół niego rozmieszczamy tleny tak, aby były jak najdalej od siebie (Rys.a). Następnie tworzymy wiązania podwójne między atomami węgla i tlenu, ponieważ tlen chce jako pierwiastek XVI grupy wytwarzać dwa wiązania i ma dwie wolne pary, które również zaznaczamy (Rys. b). Na końcu liczymy ilość punktów. Każde wiązanie podwójne to 1 punkt – suma wychodzi 2, a więc możemy węglowi przypisać hybrydyzację sp
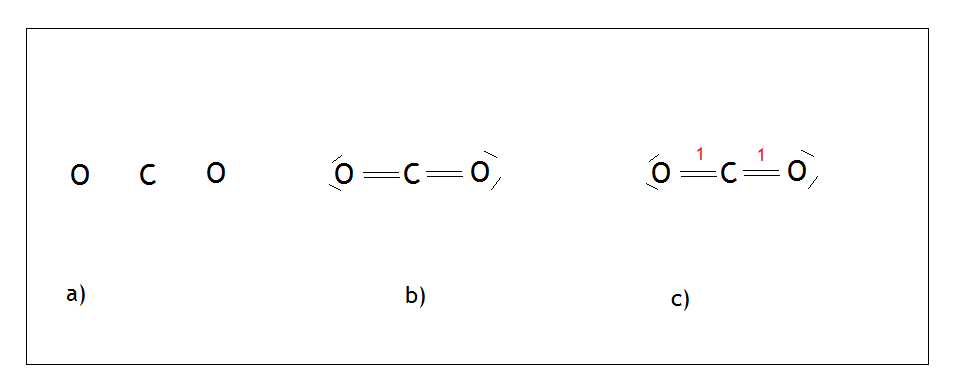
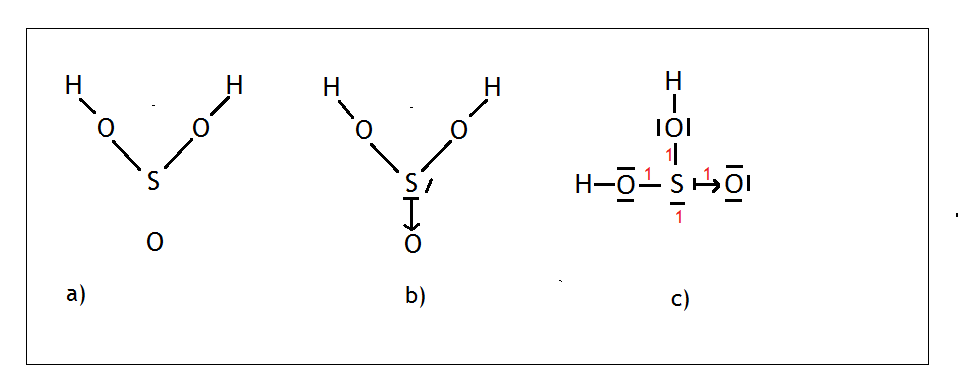
- Przykład: cząsteczka dwutlenku siarki – SO2
Siarka jako pierwiastek XVI grupy (tak samo jak tlen) może wytwarzać 2 wiązania kowalencyjne i ma 2 wolne pary. Rysujemy na środku siarkę, a tleny rozmieszczamy tak, aby były jak najdalej od siebie (Rys,a )
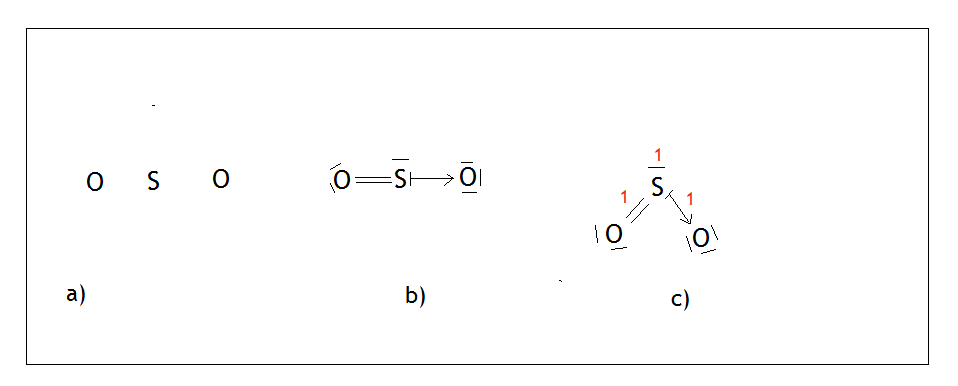
Tworzymy jedno wiązanie podwójne między siarką, a tlenem, gdyż obydwóm pierwiastkom zależy jedynie na wytworzeniu dwóch wiązań kowalencyjnych. Siarka posiada 2 wolne pary, przez które może wytwarzać wiązania koordynacyjne. W tym przypadku oddaje jedną swoją wolną parę tlenowi (Rys. b). Tlen, który przyjął parę elektronową miał sam 6 elektronów, więc zaznaczamy je jako 3 pary (tlen po prawej stronie). Na końcu rozmieszczamy atomy tlenów i wolną parę tak, aby były jak najdalej od siebie, sumujemy punkty, a skoro wynik wynosi 3 (Rys. c), wiemy że dla siarki jest to hybrydyzacja sp2. Przypominam, że wolną parę też liczymy jako jeden punkt i interesuje nas tylko atom centralny, dlatego nie liczymy tych punktów dla tlenu. Dlaczego tak jest? Ponieważ to atom centralny decyduje o kształcie cząsteczki.
- Przykład: cząsteczka etenu, czyli CH2=CH2
Węgiel jako pierwiastek XIV grupy tworzy 4 wiązania i nie ma wolnych par elektronowych (nie może tworzyć wiązań koordynacyjnych). W alkenach istnieje wiązanie podwójne między atomami węgli. Malujemy więc dwa węgle, tworzymy między nimi wiązanie podwójne, a następnie rozmieszczamy wodory tak, aby były jak najdalej od siebie (Rys.a)
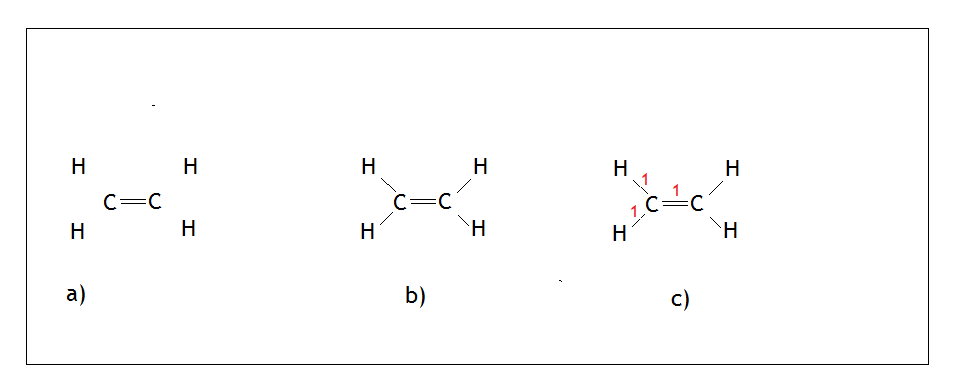
Tworzymy wiązania między węglami, a wodorami (Rys. b). Liczymy sumę punktów i uzyskany wynik – 3 sugeruje, że każdemu węglowi możemy przypisać hybrydyzację sp2. Pamiętajmy, że wiązanie podwójne i potrójne liczymy jako jeden punkt!, co zresztą pokazuje (Rys. c).
- A teraz pora na jeden z ciekawszych przykładów w liceum, czyli kation amonowy – NH4+
Rysowaliśmy przed chwilą cząsteczkę amoniaku, więc możemy ją przerysować tak samo jak poprzednio (Rys.a)
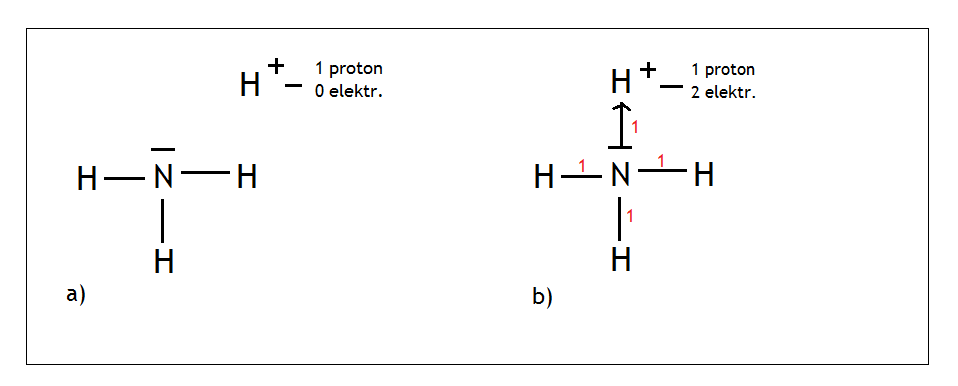
Popatrzmy na jon H+. Jeżeli policzymy, to okaże się, że ma on jeden proton i nie posiada w ogóle elektronów. Dlatego też jon ten może śmiało przyłączyć wolną parę elektronową azotu (Rys. b) i dzięki temu uzyskuje dwa elektrony stając się helem i spełnia regułę dubletu. Po zsumowaniu punktów wychodzi wynik 4, a więc mamy hybrydyzację sp3
- Przykład: cząsteczka kwasu chlorowego (V) – HClO3
Chlor jako pierwiastek grupy XVII wytwarza jedno wiązanie kowalencyjne i ma trzy wolne pary elektronowe. Malujemy chlor na środku, wokół niego rozmieszczamy w równych odległościach atomy tlenu (Rys. a) oraz malujemy jeden mostek tlenowy, czyli wodór łączy się przez tlen z chlorem.
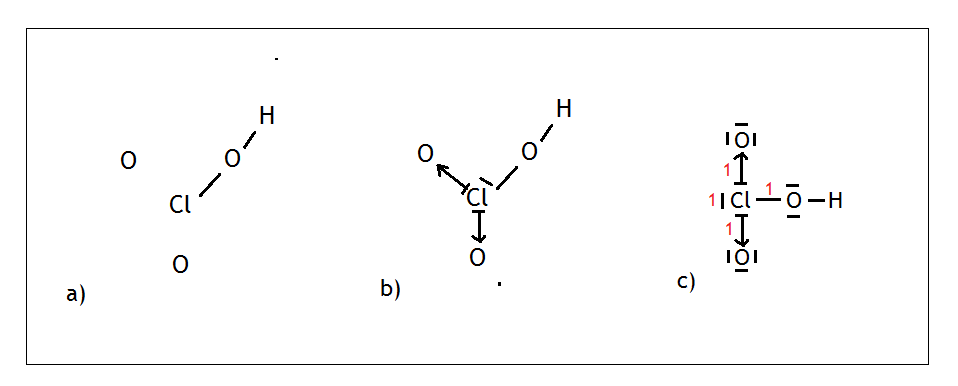
Chlor wytworzył jedno wiązanie i więcej już nie potrzebuje. Ma natomiast trzy wolne pary elektronowe. Dwie z trzech wolnych par może przekazać tlenom, natomiast jedna zostanie nieużyta (Rys. b). Rozmieszczamy tleny i wolne pary tak, aby znajdowały się najdalej od siebie, a następnie liczymy sumę punktów (Rys. c). W przypadku tej cząsteczki suma wynosi 4, a więc mamy do czynienia z hybrydyzacją sp3.
Warto również pamiętać o tzw. zasadzie „8” dla tlenu. Otóż każdy tlen musi mieć łącznie osiem elektronów. Tak więc po narysowaniu wiązań możemy zawsze uzupełniać ilość wolnych par dla tlenu tak, aby razem wyszło 8 elektronów i nie musimy zastanawiać się, ile wolnych par powinno tam być.
- Przykład: cząsteczka chlorku glinu, czyli AlCl3
Glin jako pierwiastek grupy XIII może wytwarzać 3 wiązania kowalencyjne i nie ma wolnych par. Z kolei chlor jako pierwiastek grupy XVII może wytwarzać jedno wiązanie kowalencyjne i ma trzy wolne pary elektronowe. Malujemy na środku glin, wokół niego rozmieszczamy trzy chlory (Rys. a)
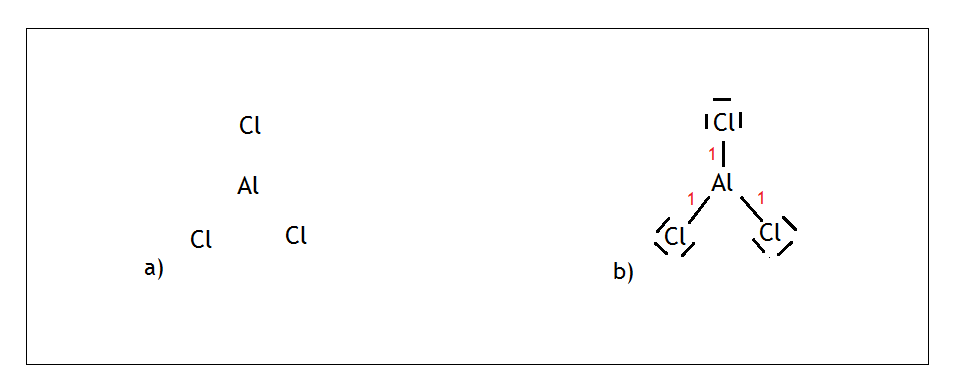
Malujemy trzy wiązania kowalencyjne, bo tyle potrzebuje glin, na atomach chloru z kolei pamiętamy, że musimy umieścić trzy wolne pary elektronowe. Liczymy sumę punktów dla glinu i wychodzi nam 3, czyli jest to hybrydyzacja sp2.
- Przykład: cząsteczka jonu hydroniowego, czyli H3O+
Ma ona budowę podobną do jonu NH4+. Tlen wytwarza dwa wiązania kowalencyjne i ma dwie wolne pary. Malujemy tlen na środku, rozmieszczamy wokół niego wodory, tak aby znajdowały się jak najdalej od siebie (Rys. a).
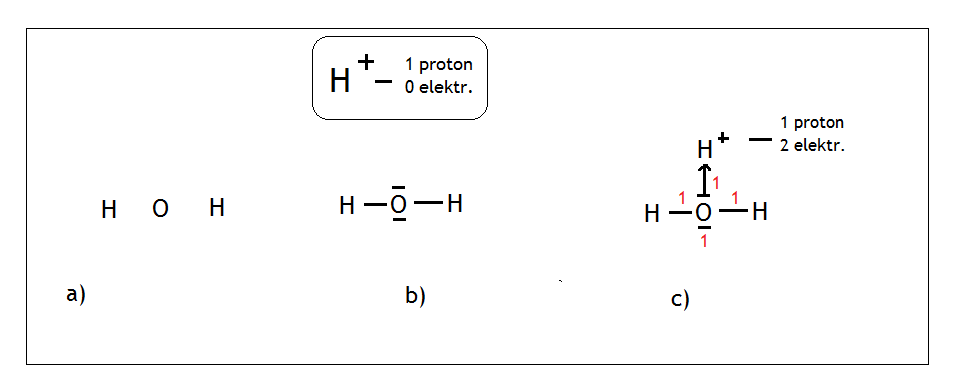
Do tlenu dodajemy dwie wolne pary elektronowe oraz zastanawiamy się jak do cząsteczki wody dołączyć jeszcze jon H+(Rys. b). Podobnie jak wcześniej, jon ten nie posiada żadnych elektronów. Może więc przyłączyć od wody parę elektronową poprzez wiązanie koordynacyjne i wtedy spełni regułę dubletu stając się helem (Rys. c). Na końcu liczymy sumę punktów, dla tlenu wynosi ona 4, a więc możemy mu przypisać hybrydyzację typu sp3.
- Przykład: anion siarczanowy (IV), czyli SO32-
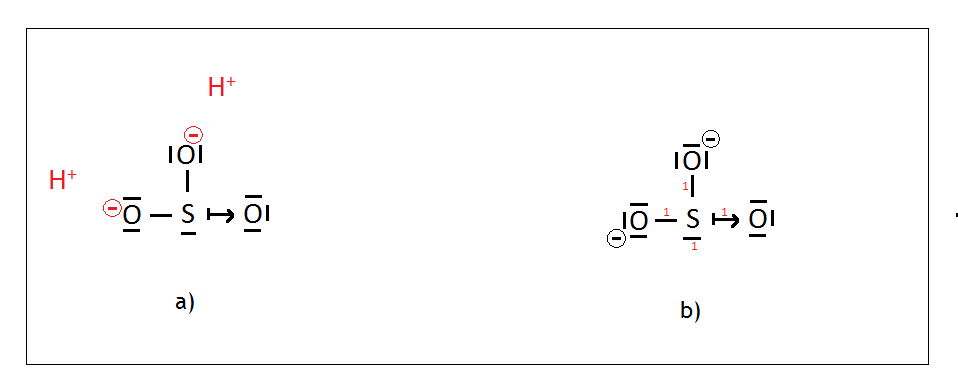
Analizując aniony kwasów najlepiej namalować na starcie kwas od którego się wywodzą, czyli w tym przypadku H2SO3. Siarka jako pierwiastek XVI grupy wytwarza 2 wiązania i ma dwie wolne pary elektronowe, tlen – tak samo. Malujemy siarkę na środku, a wokół niej rozmieszczamy w równych odległościach tleny i malujemy dwa mostki tlenowe (Rys.a).
Siarka jako że potrzebuje tylko dwa wiązania do oktetu, to owe wiązania pochodzą już z wytworzonych mostków tlenowych. Wiemy jednak, że posiada ona jeszcze dwie wolne pary elektronowe. Przez jedną z tych wolnych par może wytworzyć wiązanie koordynacyjne z atomem tlenu (Rys. b). Druga wolna para natomiast zostanie nieużyta. Na końcu poprawiamy kształt cząsteczki tak, aby wiązania i wolna para były jak najdalej od siebie (Rys. c), malujemy wolne pary dla tlenów i liczymy sumę punktów. W tym przypadku dla atomu centralnego, czyli siarki wynosi ona 4, a więc mamy do czynienia z hybrydyzacją typu sp3.
Mając za podstawę cząsteczkę kwasu przejdźmy do omówienia hybrydyzacji siarki w jonie SO32-. Jon ten powstanie w momencie w którym kwas H2SO3 zdysocjuje i odłączą się od niego dwa jony H+. Jony te odłączając się pozostawią na tlenach od których się odłączyły swoje elektrony, co spowoduje, że owe tleny zyskają ładunek -I, co pokazuje (Rys. a). Pozostaje uzupełnić wolne pary elektronowe dla tlenu oraz policzyć sumę punktów (Rys. b). Nic się nie zmieni w stosunku do kwasu – a więc hybrydyzacja siarki w tym jonie to sp3.
Raz na jakiś czas będę uzupełniał ten artykuł o inne ciekawe przypadki hybrydyzacji. Wg mnie jest to naprawdę najlepsza metoda oceniania hybrydyzacji i rysowania wzorów elektronowych.
Pozdrawiam,
Łukasz Lijewski – AKADEMIA CHEMII
Wszelkie prawa zastrzeżone!!!
Zamieszczanie jakichkolwiek fragmentów tego artykułu w innych publikacjach i stronach internetowych bez zgody autora jest zabronione.


