Dzisiaj opowiem o bardzo ważnym zagadnieniu, które jest wykorzystywane zarówno w chemii nieorganicznej jak i organicznej. Jest to wg mnie jeden z najczęściej pojawiających się braków w materiale licealnym. Wiem, że wielu nauczycieli nie tłumaczy tego zagadnienia z braku czasu lub wiedzy, a uczniowie często piszą takie równania „na czuja”. Postaram się więc dzisiaj w prosty, obrazowy sposób zsumować przyczyny reakcji wymienionych w tytule do trzech kluczowych punktów. Dla osób chcących zrozumieć więcej, polecam zapoznać się również z wyjaśnieniem dlaczego akurat istnieją 3 przyczyny takich reakcji. Konieczne pojęcia, które należy znać aby zrozumieć w pełni artykuł to: reguła przekory, stała równowagi reakcji.
Zanim zaczniemy chciałbym jeszcze dodać, że rozważania te dotyczą roztworów o średnich i niskich stężeniach oraz temperatury pokojowej. Zmieniając któryś z tych warunków, reakcje te mogą przebiegać z innymi priorytetami, ale o tym w następnym artykule.
A więc reakcje typu:
- KWAS – SÓL
- WODOROTLENEK – SÓL
- SÓL – SÓL (Jedynie przyczyna 3)
zachodzą gdy:
1. Przyczyna I: Mocniejszy kwas wypiera słabszy z jego soli lub Mocniejszy wodorotlenek wypiera słabszy z jego soli.
Kilka przykładów, aby to pokazać:
- Reakcja roztworu kwasu chlorowodorowego i siarczanu (VI) sodu:
2HCl + Na2SO4 => x
Jest to reakcja mocnego kwasu (kwas solny) z solą, która również zawiera mocny kwas (kwas siarkowy VI). Tak więc kwas solny nie wyprze kwasu siarkowego (VI) z jego soli, ponieważ obydwa kwasy są mocne.
- Reakcja kwasu azotowego (III) z bromkiem sodu:
HNO2 + NaBr => x
Reakcja ta również nie zachodzi, ponieważ kwas azotowy (III) jest kwasem słabym, więc nie wyprze kwasu bromowodorowego (mocny kwas) z jego soli.
- Reakcja kwasu chlorowego (VII) z fluorkiem potasu:
HClO4 + KF => KClO4 + HF
Reakcja ta jak najbardziej zachodzi, ponieważ kwas chlorowy (VII) jest kwasem mocnym i może dzięki temu wyprzeć słaby kwas fluorowodorowy z jego soli. Ciekawostka: powstający w reakcji kwas fluorowodorowy rozpuszcza szkło, dlatego nie można przechowywać go w szklanych naczyniach. Podobnie zresztą sytuacja wygląda z jego solą – fluorkiem potasu.
- Reakcja wodorotlenku glinu z azotanem (V) sodu:
Al(OH)3 + 3NaNO3 => x
Reakcja ta nie zachodzi, ponieważ wodorotlenek glinu jest słaby, dlatego nie wyprze mocnego wodorotlenku sodu z jego soli.
- Tą samą analogię można stosować również w chemii organicznej. Dla przykładu, ostatnim etapem otrzymywania fenolu jest reakcja fenolanu sodu z kwasem węglowym:

Reakcja ta zachodzi, gdyż kwas węglowy (Ka2 = 4,68*10-11) jest mocniejszym kwasem od fenolu (Ka = 1,02*10-10), dlatego wyprze go z jego soli.
2. Przyczyna II: w wyniku reakcji wydziela się gaz.
Na poziomie liceum warto znać 4 związki, które ulatniają się w formie gazu jeżeli powstają w reakcjach. Są to:
Kwas węglowy, który rozpada się na: CO2↑ + H2O
Kwas siarkowy (IV), który rozpada się na: SO2↑ + H2O
Wodorotlenek amonu (woda amoniakalna), która rozpada się na: NH3↑ + H2O
Kwas siarkowodorowy który ulatnia się w postaci H2S↑
Jeżeli więc w reakcji powstanie któryś z wymienionych produktów, to taka reakcja na pewno zachodzi. Oto kilka przykładów:
- Reakcja wodorotlenku potasu z chlorkiem amonu:
KOH + NH4Cl => KCl + NH3↑ + H2O
W reakcji tej powstaje wodorotlenek amonu, który ulega rozkładowi na amoniak i wodę. Reakcja ta zachodzi również, z uwagi na to że wodorotlenek potasu jako mocny wodorotlenek wypiera słabszy (wodorotlenek amonu) z jego soli.
- Reakcja kwasu siarkowego (VI) z siarczkiem sodu:
H2SO4 + Na2S => Na2SO4 + H2S↑
W wyniku reakcji powstaje kwas siarkowodorowy, który ulatnia się w postaci gazu o zapachu zgniłych jaj. Reakcja ta zachodzi również, gdyż mocniejszy kwas wypiera słabszy z jego soli.
- Reakcja kwasu bromowodorowego z węglanem sodu:
2HBr + Na2CO3 => 2NaBr + CO2↑ + H2O
Ta reakcja również zachodzi, gdyż w wyniku reakcji powstaje kwas węglowy, który jest nietrwały i rozpada się na dwutlenek węgla i wodę. Przy okazji zachodzi ona również, gdyż mocniejszy kwas (kwas bromowodorowy) wypiera słabszy (kwas węglowy) z jego soli.
3. Przyczyna III: W wyniku reakcji wydziela się osad.
Jest to przyczyna dla której zachodzą reakcje typu sól-sól, ale także dotyczy ona reakcji wodorotlenek-sól oraz kwas-sól. Dla przykładu:
- Reakcja siarczanu (VI) sodu z azotanem (V) potasu:
Na2SO4 + KNO3 => x
Reakcja nie zachodzi, ponieważ obydwa produkty, które by powstały: K2SO4 oraz NaNO3 są rozpuszczalne. (Oczywiście, sytuacja ta dotyczy mieszania roztworów o średnim stężeniu i niskim stężeniu. Jeżeli natomiast zmieszalibyśmy roztworu nasycone obydwóch substancji, to istnieje możliwość powstania osadu.)
- Reakcja azotanu (V) srebra z chlorkiem potasu:
AgNO3 + KCl => AgCl↓ + KNO3
Reakcja ta zajdzie, gdyż powstały wskutek wymiany chlorek srebra jest nierozpuszczalny.
- Reakcja roztworu krzemianu (IV) sodu i kwasu chlorowodorowego:
Na2SiO3 + 2HCl => 2NaCl + H2SiO3↓
Reakcja ta zachodzi tak naprawdę z dwóch przyczyn: mocniejszy kwas (HCl) wyparł słabszy (H2SiO3↓) z jego soli oraz dlatego, że w wyniku reakcji wytrąca się osad kwasu krzemowego. Kwas krzemowy (IV) lepiej byłoby tak naprawdę zapisywać w postaci: SiO2 x H2O, ponieważ ulega on dość łatwo rozpadowi do krzemionki. Tak więc powstający osad jest nie tyle kwasem krzemowym w dosłownym tego znaczeniu, co powstałym wskutek jego rozpadu tlenkiem krzemu i innymi krzemianami.
- Reakcja roztworów azotanu (V) glinu oraz wodorotlenku baru:
2Al(NO3)3 + 3Ba(OH)2 => 2Al(OH)3↓ + 3Ba(NO3)2
Reakcja ta również zachodzi z dwóch przyczyn: po pierwsze, mocniejszy wodorotlenek (Ba(OH)2) wypiera słabszy (Al(OH)3) z jego soli oraz dlatego, że w wyniku reakcji wytrąca się osad wodorotlenku glinu. Należy tutaj wspomnieć o pewnej rzeczy, otóż jeżeli dodamy wodorotlenku baru za dużo, to wydzielony osad Al(OH)3↓ z uwagi na amfoteryczny charakter roztworzy się w reakcji z nadmiarem Ba(OH)2,
4. Wytłumaczenie omówionych wcześniej 3 przyczyn.
Wyżej wymienionych zasad można nauczyć się na pamięć, jednak warto również spróbować chociaż po części zrozumieć procesy, które toczą się podczas tych reakcji. Same opisane przeze mnie przyczyny są licealnym uproszczeniem. Wyjaśnienie również będzie pewnego rodzaju uproszczeniem, ale i tak sądzę że na poziomie liceum jest to bardzo dobra argumentacja.
- Wyjaśnienie 3 przyczyny reakcji, czyli „powstaje osad”.
Omówmy przebieg reakcji roztworu azotanu (V) baru i siarczanu (VI) sodu:
Ba(NO3)2 + Na2SO4 => BaSO4↓ + 2NaNO3
Reakcja ta zachodzi, gdyż wskutek wymiany powstaje osad siarczanu (VI) baru. Musimy zrozumieć, że reakcje które toczą się w roztworze wodnym między elektrolitami, to nie reakcje między cząsteczkami, a między samymi jonami (oczywiście, jeżeli elektrolit dysocjuje w 100%) Dlatego o wiele bardziej czytelny z chemicznego punktu widzenia jest zapis jonowy, ponieważ w tym przypadku obydwie sole dysocjują w ok. 100%.:
Ba2+ + 2NO3– + 2Na+ + SO42- => BaSO4↓ + 2Na+ + 2NO3–
Tak więc w roztworze wodnym mamy jony, które nieustannie zderzają się ze sobą tworząc cząsteczki (w przypadku soli nie powinniśmy używać słów cząsteczki, ale zrobiłem to, aby lepiej to wyjaśnić) które rozpadają się jeżeli dana cząsteczka jest dobrze rozpuszczalna:
2Na+ + SO42- => Na2SO4 => 2Na+ + SO42-
Na+ + NO3– => NaNO3 => Na+ + NO3–
Jeżeli natomiast zderzy się ze sobą jon Ba2+ oraz SO42-, to powstająca sól jest nierozpuszczalna i nie rozpada się ponownie:
Ba2+ + SO42- => BaSO4↓
Można powiedzieć, że w reakcji tej ustala się równowaga:
Ba2+ + SO42- <=> BaSO4↓
Tyle, że równowaga tej reakcji jest arcymocno przesunięta w prawą stronę, ponieważ cząsteczka osadu BaSO4 jest stabilniejsza od jonów Ba2+ i SO42-
Dlatego więc, reakcje w których powstają osady wskutek wymiany są preferowane, gdyż równowagi tych reakcji są mocno przesunięte w stronę produktów, gdyż osady są stabilniejsze od jonów.
- Wyjaśnienie 2 przyczyny reakcji, czyli „powstaje gaz”.
Rozpatrzmy reakcję między roztworami wodnymi kwasu solnego oraz węglanu sodu. Zapiszmy tą reakcję w formie cząsteczkowej oraz tej bardziej logicznej z punktu widzenia roztworów wodnych – formie jonowej:
2HCl + Na2CO3 => CO2↑ + H2O + 2NaCl
2H++ 2Cl–+ 2Na+ + CO32- => CO2↑ + H2O + 2Na++ 2Cl–
Dlaczego reakcje w których powstają gazy są preferowane? Otóż tutaj dużo można zrozumieć poprzez regułę przekory. Kwas węglowy jest kwasem bardzo nietrwałym, tak naprawdę cząsteczek samego kwasu węglowego jest bardzo mało. Powstający w wyniku reakcji kwas węglowy ulega w większości rozpadowi na CO2 + H2O. Można zapisać to w następujący sposób:
2H+ + CO32- => H2CO3 => CO2↑ + H2O
Szczególnie interesuje nas druga część tego schematu i miejsce w którym ustala się następujący stan równowagi:
H2CO3 <=> CO2↑ + H2O
Z uwagi na to, że kwas węglowy jest nietrwały, albo inaczej, z uwagi na to że cząsteczka CO2↑ jest trwalsza od kwasu węglowego, równowaga tej reakcji jest mocno przesunięta w prawą stronę. Dodatkowo wiemy, że jeżeli powstający CO2↑ ulatnia się, gdyż jest gazem, to zgodnie z regułą przekory układ będzie chciał zwiększyć jego stężenie, co dodatkowo przesuwa tą reakcję w prawo.
Dlatego więc, reakcje w których powstają gazy wskutek wymiany są preferowane, gdyż reguła przekory przesuwa równowagę takich reakcji właśnie w stronę gazowych produktów.
- Wyjaśnienie 1 przyczyny reakcji, czyli „mocniejszy wypiera słabszego z soli”.
Rozważmy reakcję między kwasem bromowodorowym i azotanem (III) sodu. Zapiszmy równanie w formie cząsteczkowej i jonowej:
HBr + NaNO2 => HNO2 + NaBr
H+ + Br‑ + Na+ + NO2– => HNO2 + Na+ + Br–
Większość osób wie, że mocny kwas wypiera słabszy z jego soli. Pytanie tylko, dlaczego? Otóż popatrzmy oddzielnie na dysocjację obydwóch kwasów.
Na początku popatrzmy na dysocjację kwasu bromowodorowego:
HBr => H+ + Br–
Reakcja ta jest przesunięta tak bardzo w prawą stronę, że trudno tutaj mówić o stanie równowagi (Ka = 3*109). Możemy powiedzieć jednak, że jest to stan równowagi, który jest kolosalnie i przedrastycznie przesunięty w prawą stronę.
Z drugiej strony mamy dysocjację kwasu azotowego (III):
HNO2 <=> H+ + NO2–
Równowaga tej reakcji jest przesunięta natomiast w lewą stronę (Ka = 5,1*10-4), czyli w stronę cząsteczek kwasu azotowego (III), gdyż kwas ten jest słaby, albo mówiąc inaczej cząsteczki HNO2 są preferowane z energetycznego punktu widzenia w stosunku do jonów na które dysocjują. Tak więc, jeżeli spojrzymy na równanie reakcji w formie jonowej jeszcze raz:
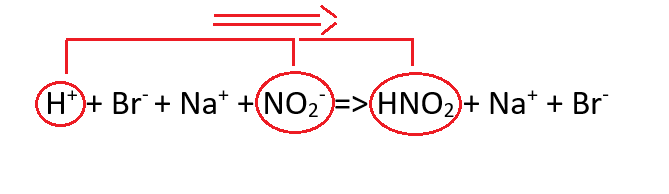
Zobaczymy, że jony H+ pochodzące od kwasu HBr zderzając się z jonami NO2– pochodzącymi od azotanu (III) sodu powodują powstanie kwasu azotowego (III). Z uwagi na to, że równowaga dysocjacji kwasu HNO2 jest przesunięta w stronę cząsteczek kwasu azotowego (III), reakcja ta mocno kieruje się w prawą stronę.
Można więc powiedzieć, że mocniejszy kwas wypiera słabszy z jego soli lub mocniejszy wodorotlenek wypiera słabszy z jego soli, gdyż równowaga reakcji dysocjacji słabego kwasu/zasady przesunięta jest w stronę cząsteczek, a nie jonów, co napędza cały proces wypierania słabego kwasu/wodorotlenku z jego soli przez mocniejszy kwas/wodorotlenek.
Podsumowując, to reguła przekory oraz stałe równowagi reakcji napędzają przebieg reakcji w roztworach wodnych. Można również powiedzieć, że reakcje tego typu zachodzą, gdyż produkty tych reakcji mają stabilniejszą energię niż substraty.
Pozdrawiam,
Łukasz Lijewski – AKADEMIA CHEMII
Wszelkie prawa zastrzeżone!!!
Zamieszczanie jakichkolwiek fragmentów tego artykułu w innych publikacjach i stronach internetowych bez zgody autora jest zabronione.


