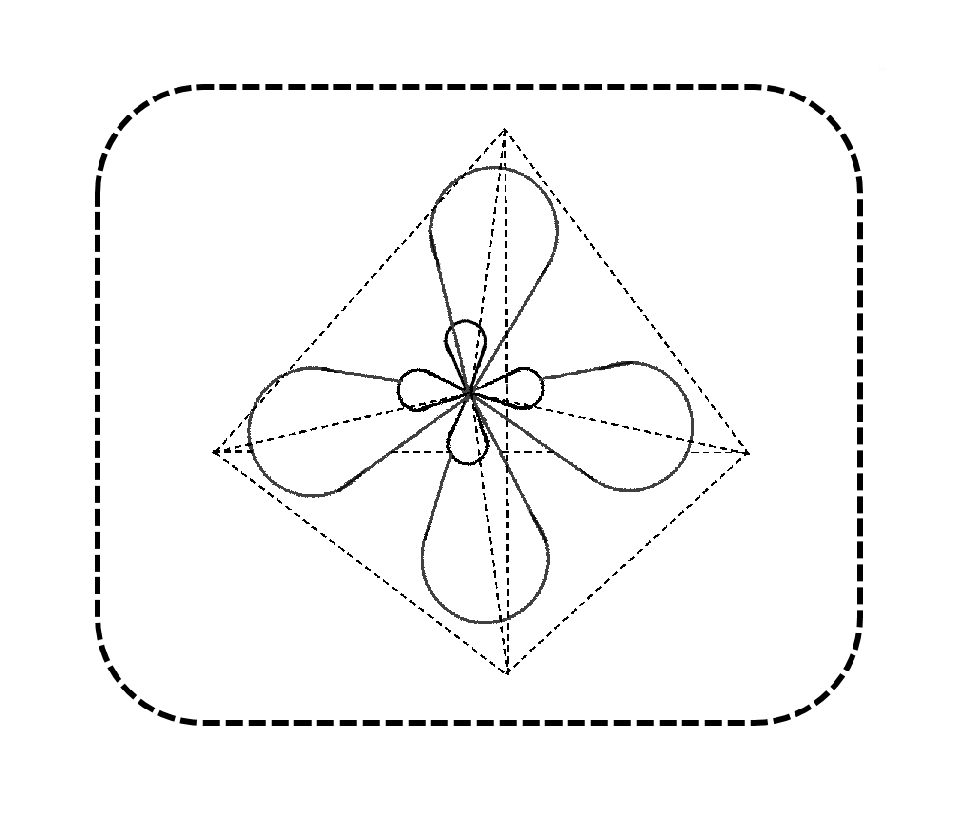
1. Określanie kształtu cząsteczki na podstawie hybrydyzacji atomu centralnego:
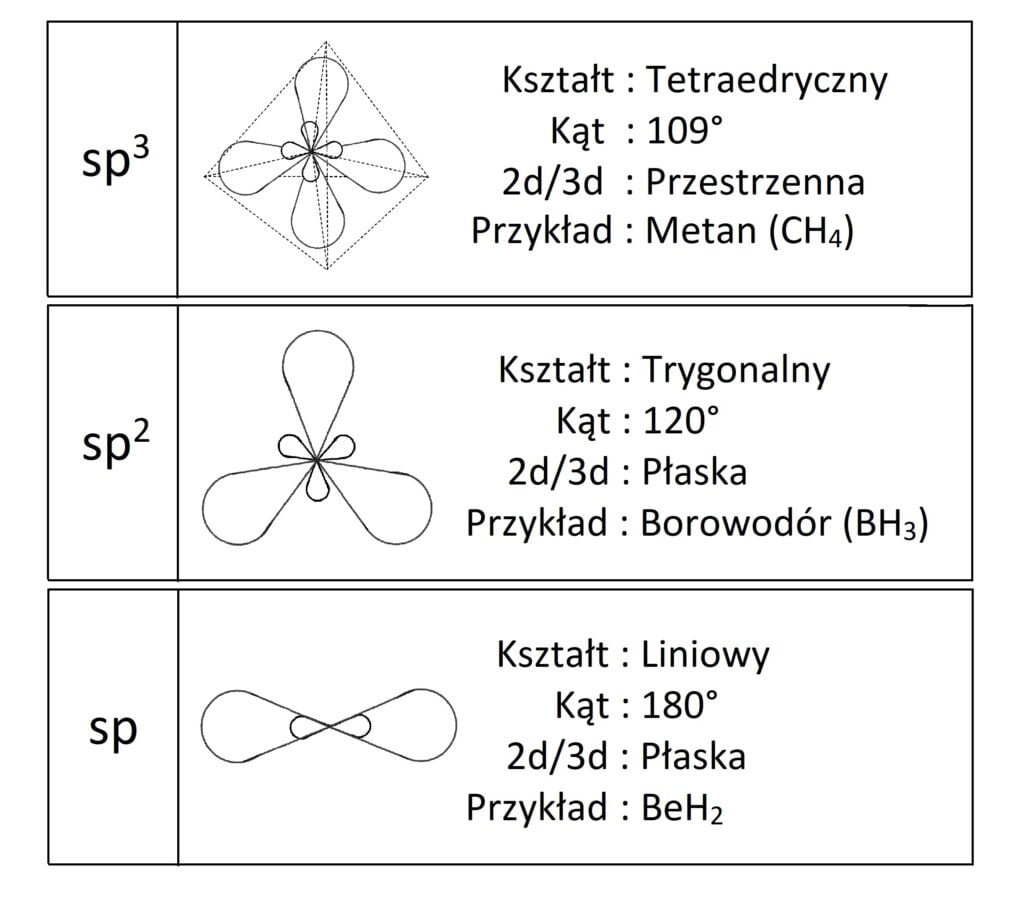
Jak dobrze wiemy, o kształcie cząsteczki decyduje atom centralny, tj. pierwiastek wokół którego rozmieszczone są inne pierwiastki budujące dany związek chemiczny. Możemy określać(przypisywać) tak naprawdę hybrydyzację każdego z pierwiastków w związku chemicznym, ale to atom centralny definiuje kształt. W licealnej chemii znamy dobrze trzy podstawowe hybrydyzacje dla których przypisujemy kształty i parametry przedstawione poniżej w tabeli:
Sytuacja jednak komplikuje się gdy atom centralny dysponuje wolną parą elektronową. W takich przypadkach kształty przedstawione powyżej przestają być obowiązujące. I tak dla przykładu, cząsteczka wody: H2O, w której dla tlenu można przypisać hybrydyzację sp3 wcale nie ma kształtu tetraedrycznego, a kątowy. Jest to związane z faktem, że wolne pary dopóki nie wytworzą żadnych wiązań są tworem wirtualnym, tzn. znajdują się przy danym atomie centralnym, ale nie wpływają na kształt przez niego warunkowany. Rozważmy więc jak wyglądają cząsteczki w których atom centralny posiada wolne pary elektronowe.
Hybrydyzacja typu sp3 z 1 wolną parą dla atomu centralnego.
Dla hybrydyzacji tej charakterystyczny jest tetraedr. Jednak jeżeli w miejscu jednego z orbitali pojawi się wolna para (Rys. 1), to kształt cząsteczki jest zupełnie inny.
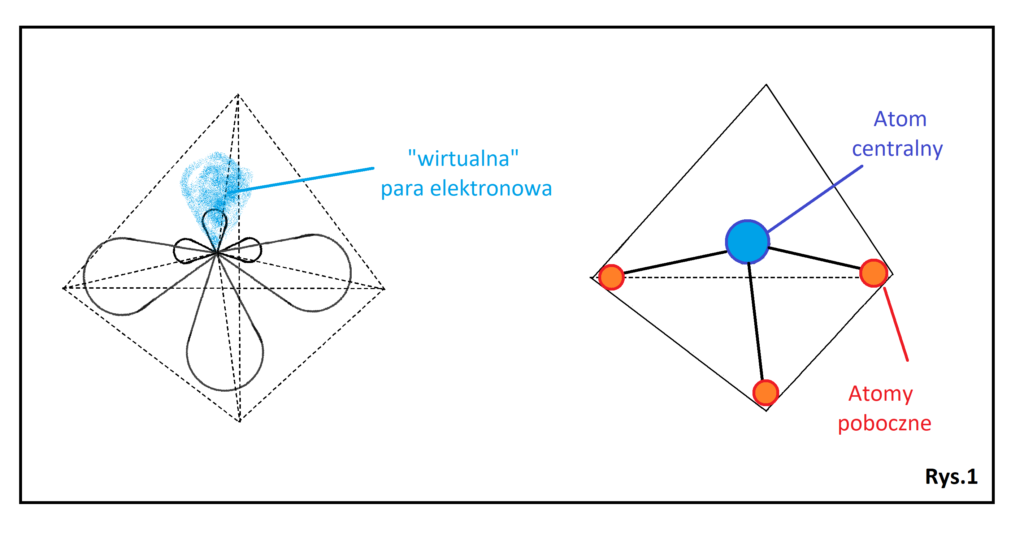
Na rysunku, po lewej stronie widać „wirtualną” parę elektronową niewpływającą na kształt cząsteczki, natomiast po prawej stronie widzimy właściwy kształt cząsteczki już bez uwzględnienia wolnej pary – tzw. piramidę trygonalną, Kąty między wiązaniami wynoszą mniej niż 109°, co związane jest z deformującym wpływem wolnej pary na kąt między tymi wiązaniami. Przykładem cząsteczki o takim kształcie jest amoniak (NH3), gdzie kąt między wiązaniami to ok 107°. Cząsteczka ta jak widać na rysunku jest przestrzenna.
Hybrydyzacja typu sp3 z 2 wolnymi parami dla atomu centralnego.
Jeszcze ciekawsza sytuacja ma miejsce w przypadku występowania dwóch wolnych par przy atomie centralnym. Skoro wolne pary nie wpływają na kształt cząsteczki, bo są „duchami przestrzennymi”, to cząsteczka taka stanie się nagle płaska (Rys.2).
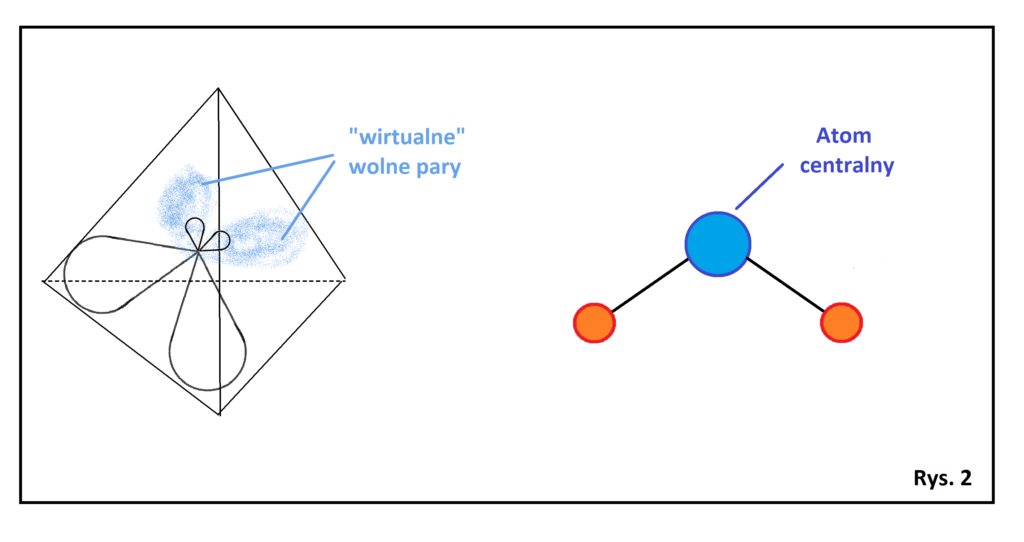
Dlaczego cząsteczka taka jest płaska? Jeżeli wokół atomu centralnego rozmieszczone są dwie wolne pary nie wpływające na kształt cząsteczki, to zyskujemy 3 „rzeczywiste indywidua”. Jeżeli trzy takie indywidua rozmieścimy w dowolny sposób w trójwymiarowej rzeczywistości, to po dowolnym ich połączeniu za pomocą dwóch wiązań, zawsze uzyskamy kształt płaski, Kształt ten nazywamy kątowym, a kąt między wiązaniami jest mniejszy od 109°. Przykładem cząsteczki o takim kształcie jest woda (H2O), a w przypadku wody wynosi ok 104°. Kąt ten odbiega jeszcze bardziej od 109 stopni, co związane jest z obecnością aż dwóch wolnych par elektronowych.
Hybrydyzacja typu sp2 z 1 wolną parą elektronową dla atomu centralnego.
Jeżeli atom centralny posiada jedną wolną parę elektronową i charakteryzuje się się hybrydyzacją typu sp2 , to kształt takiej cząsteczki nie będzie trygonalny, ale analogiczny wobec tego z (Rys.3)
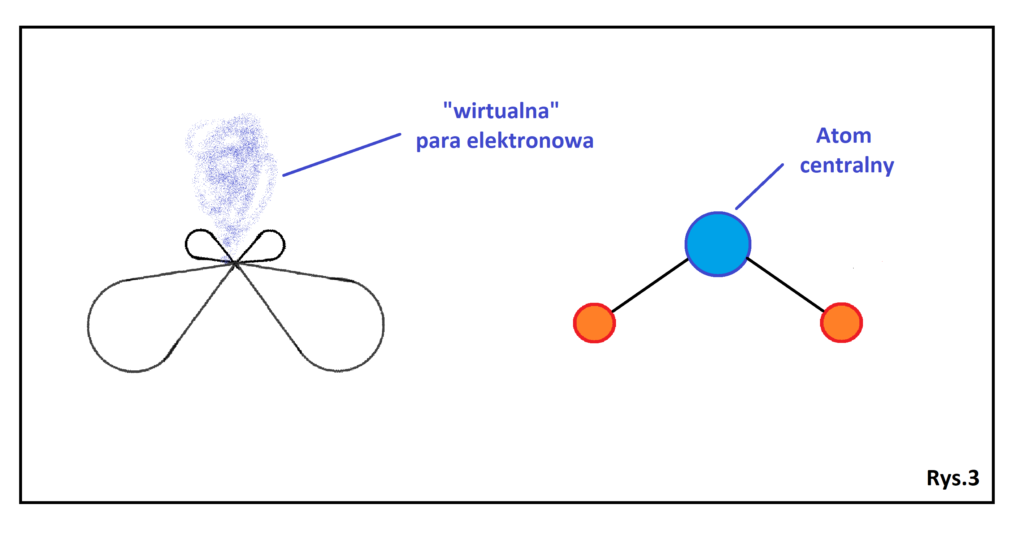
Usuwając jeden z orbitali z kształtu trygonalnego uzyskujemy ponownie trzy indywidua po połączeniu których uzyskamy kształt kątowy. Cząsteczka ta jest płaska, a kąty między wiązaniami wynoszą mniej niż 120° z uwagi na obecność wolnej pary, która deformuje kąty w porównaniu do tradycyjnego kształtu trygonalnego. Przykładem cząsteczki charakteryzującej się takim kształtem jest tlenek siarki IV (SO2).
Uwaga: Osoby chcące uzyskać dostęp do pokazanej powyżej planszy w wysokiej rozdzielczości, mogą uzyskać więcej informacji na ten temat na Facebooku AKADEMII CHEMII. (NALEŻY UDOSTĘPNIĆ POST W CELU OTRZYMANIA 3 PLANSZ.)
Określanie kształtu cząsteczek posiadających dwa równocenne atomy centralne.
Warto zwrócić uwagę na fakt, że o ile możemy określić kształt cząsteczki metanu (CH4) po przypisaniu hybrydyzacji atomowi centralnemu (węgiel), to nie można już w analogiczny sposób opisywać kształtu cząsteczek posiadających dwa równorzędne atomy C, czyli chociażby etenu (CH2=CH2). Każdemu węglowi moglibyśmy przypisać hybrydyzację typu sp2 , co nie oznacza jednocześnie, że cała cząsteczka ma kształt trygonalny. Co najwyżej możemy powiedzieć, że wokół każdego z węgli rozłożenie orbitali jest trygonalne, ale nie kształt całej cząsteczki! Aby to lepiej zobrazować wystarczy spojrzeć na wzór strukturalny etenu.

Tak więc możemy określić kształt cząsteczek posiadających 1 równorzędny atom centralny, jak chociażby: CH4 – kształt tetraedru; BeCl2 – kształt liniowy, ale nie określimy kształtów takich cząsteczek jak propan, czy but-2-en.
2. Wyjaśnienie natury hybrydyzacji.
Na początku należałoby podkreślić jedną rzecz: Hybrydyzacja jest tak naprawdę zabiegiem bardziej matematycznym, niż praktycznym. W artykule tym używam słów „pierwiastek ulega hybrydyzacji”, ale tak naprawdę hybrydyzacja jest pewnym modelem, mającym na celu wizualne przedstawienie rozwiązań równań matematycznych i funkcji, swego rodzaju próbą uproszczonego opisu tego, co dzieje się w nie do końca zrozumiałym świecie kwantowym za pomocą najbardziej intuicyjnego dla nas sposobu – rysunku.
Ale do sedna.
Po co elektrony walencyjne pierwiastków ulegają hybrydyzacji w trakcie tworzenia wiązań chemicznych? Nie spotkałem się jeszcze z rzeczowym wyjaśnieniem tego procesu na poziomie licealnych książek. Rzeczowym oczywiście nie oznacza sięganie po fizyczne modele i tłumaczenie tych zagadnień w języku matematyki. W gruncie rzeczy, odpowiedź na to pytanie jest bardzo prosta, co zobaczymy za chwilę. Przeanalizujmy cząsteczkę metanu (CH4). Węgiel w stanie podstawowym ma następującą konfigurację powłoki walencyjnej:
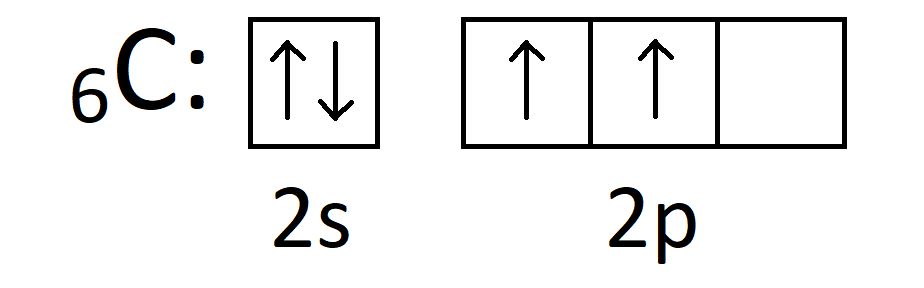
Pierwiastki mogą wytwarzać wiązania kowalencyjne (pomijając wiązania koordynacyjne) jedynie przez niesparowane elektrony. Tak więc węgiel zgodnie z powyższym zapisem mógłby wytworzyć jedynie 2 wiązania kowalencyjne. Istnieje jednak cząsteczka CH4. Jak to możliwe?
Węgiel może ulegać wskutek hybrydyzacji wzbudzeniu, co pokazuje poniższy rysunek. Wzbudzenie polega na przeskoku sparowanego elektronu na pusty orbital kolejnej podpowłoki. Stan wzbudzony oznaczamy za pomocą „*”
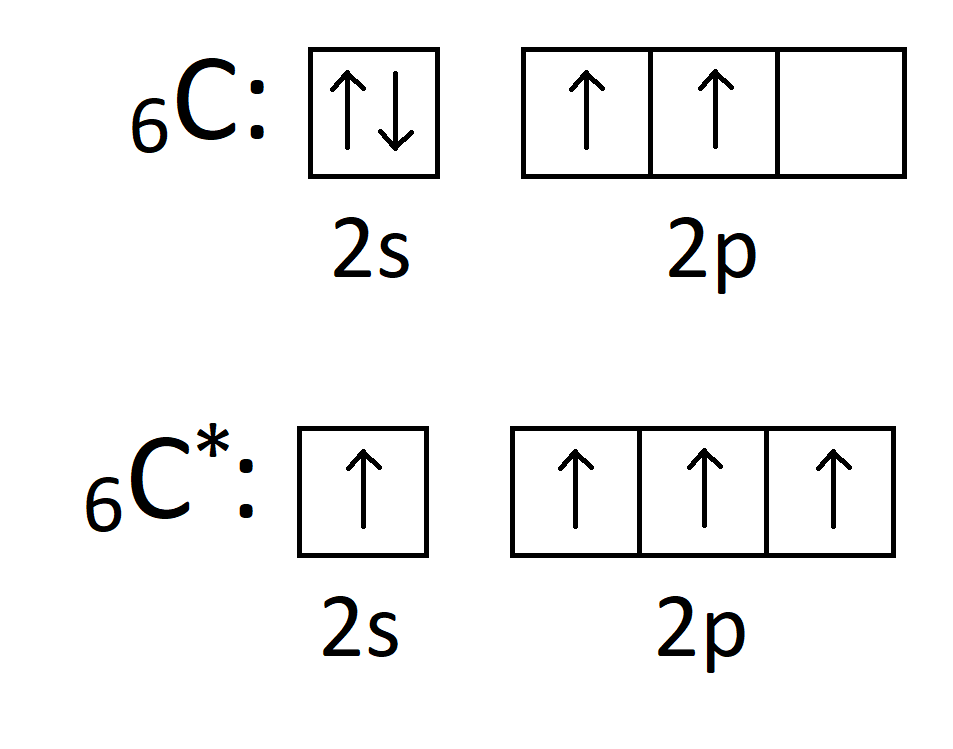
Widzimy, że po wzbudzeniu atom węgla może wytwarzać 4 wiązania zamiast 2 w stanie podstawowym. Tak więc elektrony walencyjne w atomie ulegają hybrydyzacji po to, aby dany atom mógł wytworzyć jak najwięcej wiązań. Jednakże pozostaje jeszcze drugi powód hybrydyzacji. Otóż jak dobrze wiemy podpowłoka 2p ma energię wyższą niż podpowłoka 2s. Tak więc gdyby elektrony walencyjne nie ulegały hybrydyzacji, 2 wiązania (te pochodzące od elektronów z 2p) miałyby energię wyższą od tych pochodzących z podpowłoki 2s. Tak więc poza tym, że elektrony walencyjne ulegają wzbudzeniu wskutek hybrydyzacji, to dochodzi również do wyrównania energii tych orbitali po hybrydyzacji. Szkic przedstawiający stan energetyczny elektronów walencyjnych przed i po hybrydyzacji pokazany jest na rysunku poniżej.
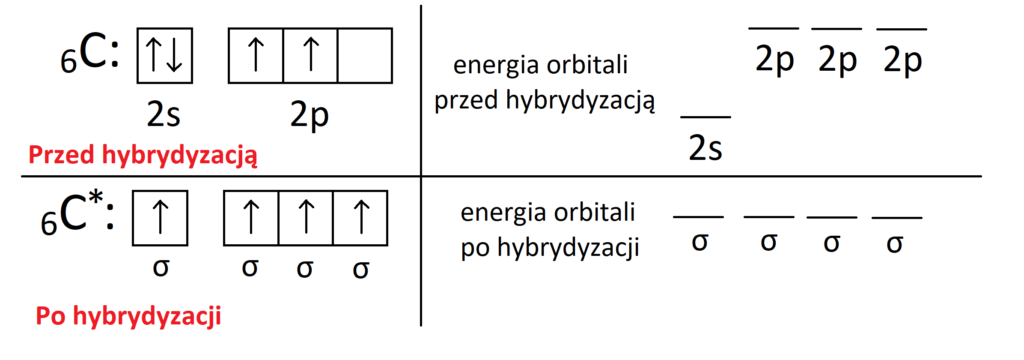
Widzimy, że po hybrydyzacji poziom energetyczny wszystkich orbitali uległ wyrównaniu. Dzięki temu wszystkie wiązania kowalencyjne po hybrydyzacji mają jednakową energię, co umożliwia istnienie stabilnej cząsteczki. Jednocześnie po hybrydyzacji nie mamy już do czynienia z orbitalami 2s i 2p, ale z jednakowymi orbitalami σ „sigma” o takiej samej energii. Dlatego też po hybrydyzacji następuje zmiana kształtu orbitali dla elektronów walencyjnych. Tak więc hybrydyzacja w gruncie zachodzi z dwóch przyczyn:
- Po to, aby dany atom mógł wytworzyć jak najwięcej wiązań
- Po to, aby powstałe wiązania miały jednakową energię.
Przeanalizujmy jeszcze 2 przykład, czyli cząsteczkę wody : H2O.
Możemy zadać sobie pytanie: Po co elektrony walencyjne tlenu ulegają hybrydyzacji sp3, skoro tlen przed hybrydyzacją może i tak wytwarzać dwa wiązania? Spójrzmy na wzór elektronowy tlenu :
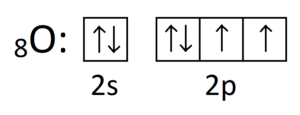
Tlen wytwarza 2 wiązania kowalencyjne i posiada 2 wolne pary elektronowe. Po co więc tlen ulega hybrydyzacji, skoro wskutek niej i tak nie wytworzy większej ilości wiązań? Otóż, spojrzmy na orbitale i wolne pary.
Wiemy dobrze, że energia orbitalu 2p jest wyższa niż energia orbitalu 2s. Tak więc jeżeli tlen nie uległby hybrydyzacji, to jedna wolna para miałaby energię inną od drugiej, co pokazuje poniższy szkic.
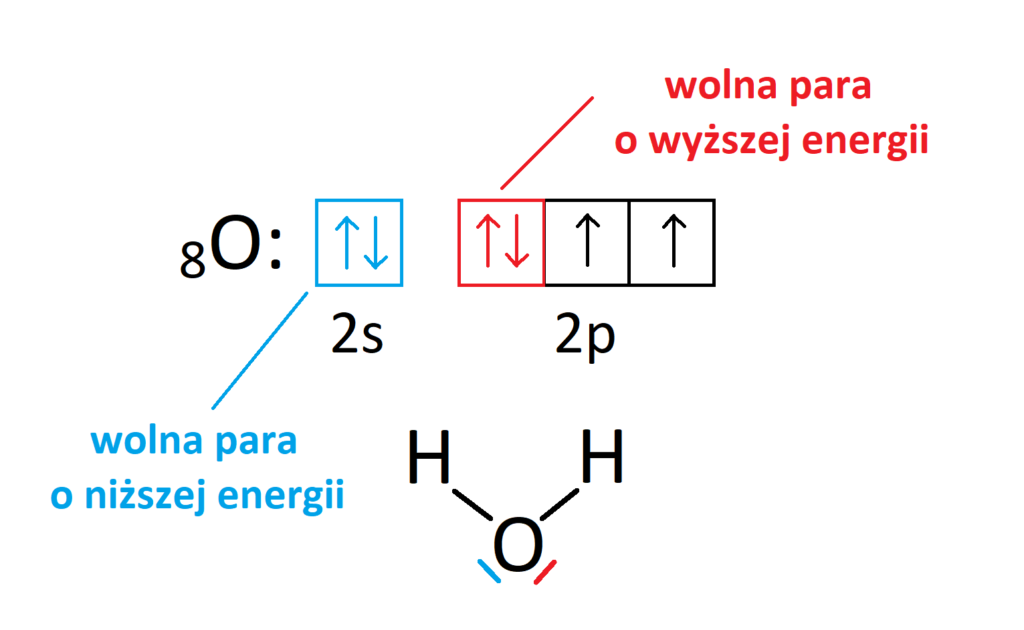
Poza tym, należy postrzegać wolne pary jako równoprawne zwykłym elektronom z wiązań kowalencyjnych. Tak więc elektrony walencyjne tlenu muszą ulec hybrydyzacji, aby wyrównać energię wszystkich elektronów, bo przecież wolne pary mogą wytwarzać wiązania koordynacyjne. W przypadku tej hybrydyzacji nie dojdzie jednak do wzbudzenia, bo elektrony nie mają „gdzie przeskoczyć”, a jedynie energia wszystkich orbitali uśredni się, co pokazuje poniższy rysunek:
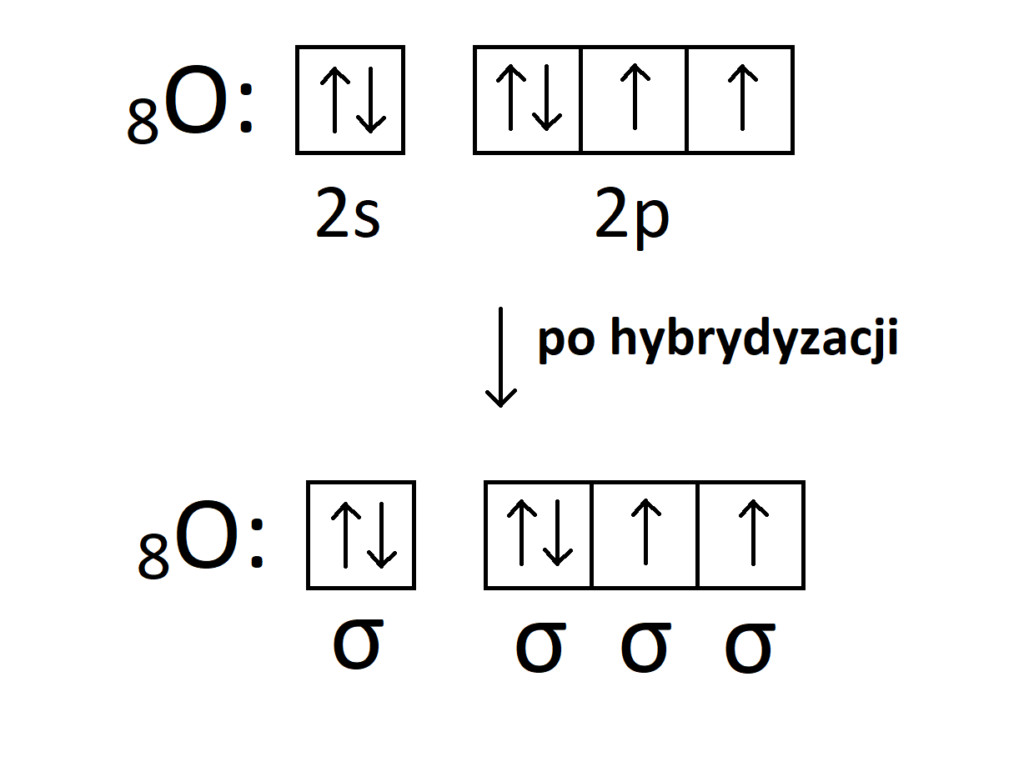
Tak więc jedyną różnicą w porównaniu do stanu przed hybrydyzacją jest uśrednienie energii wszystkich orbitali. Może więc dochodzić do hybrydyzacji elektronów walencyjnych tylko po to, aby wyrównać poziom energetyczny wszystkich elektronów (bez etapu wzbudzenia).
Pozostaje do omówienia jeszcze kwestia wiązań wielokrotnych, tj typu π. Dlaczego w cząsteczce etenu elektronom walencyjnym węgla przypisuje się hybrydyzację typu sp2, a nie sp3, jak wynikałoby z rozłożenia elektronów na orbitalach po hybrydyzacji atomu węgla, co pokazuje poniższy rysunek?
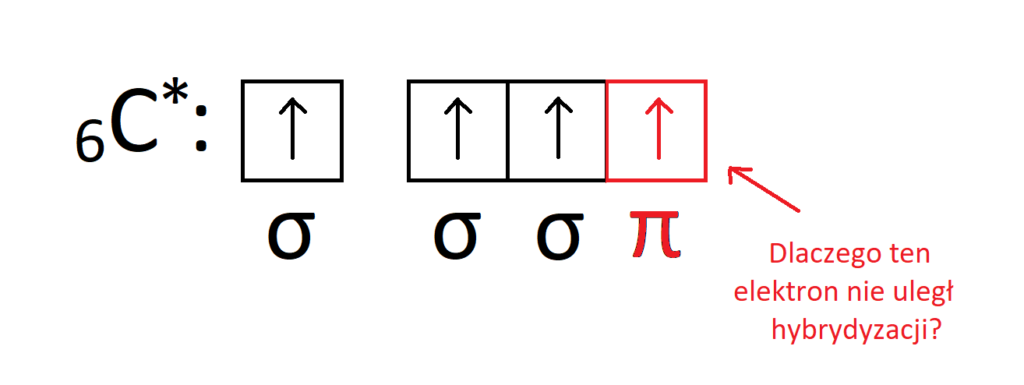
Oraz na wzór strukturalny etenu:

Jak dobrze wiemy, dla alkenów (w tym etenu) charakterystyczne są reakcje addycji w których dochodzi do rozerwania wiązania podwójnego, czyli tego w którym uczestniczą elektrony z orbitalu π. Przykładem takiej reakcji jest addycja bromu do cząsteczki etenu, co pokazuje poniższy rysunek:
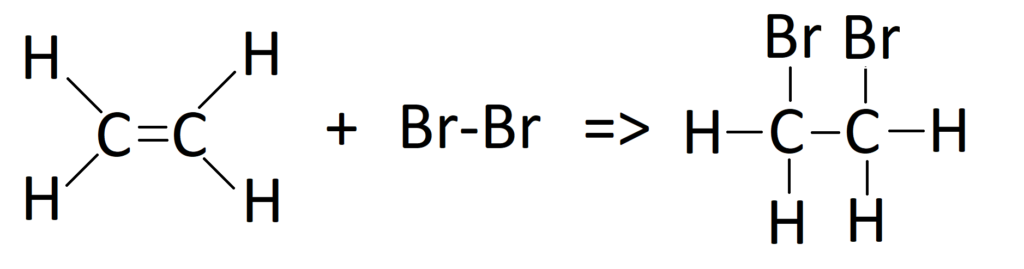
Reakcja to unaocznia, że wiązanie typu π jest o wiele mniej trwałe w stosunku do wiązania typu σ. A skoro jest mniej trwałe i ulega stosunkowo łatwo zerwaniu, to nie może mieć takiej samej energii jak wiązanie σ. Tak więc elektron z ostatniego orbitalu (π) musi mieć energię wyższą od tych z orbitali σ. Z czego to wynika? Otóż węgle tworząc między sobą wiązanie pojedyncze wykorzystują w tym celu przestrzeń pomiędzy nimi, tworząc wiązanie wskutek czołowego nakładania się orbitali. Na poniższym rysunku zaznaczono czerwonymi kropkami atomy węgli, natomiast wiązanie σ na żółto.

Skoro węgle wykorzystały wskazane na żółto orbitale do wytworzenia wiązania pojedynczego, to pytanie brzmi: „Gdzie może wytworzyć się wiązanie podwójne (π), skoro przestrzeń między węglami została już wykorzystana do wytworzenia wiązania σ?” Otóż wiązanie typu π wytwarza się wskutek bocznego nakładania się orbitali typu π, ponieważ nie ma fizycznie miejsca, aby orbitale mogły nakładać się czołowo. Widać to na rysunku poniżej.
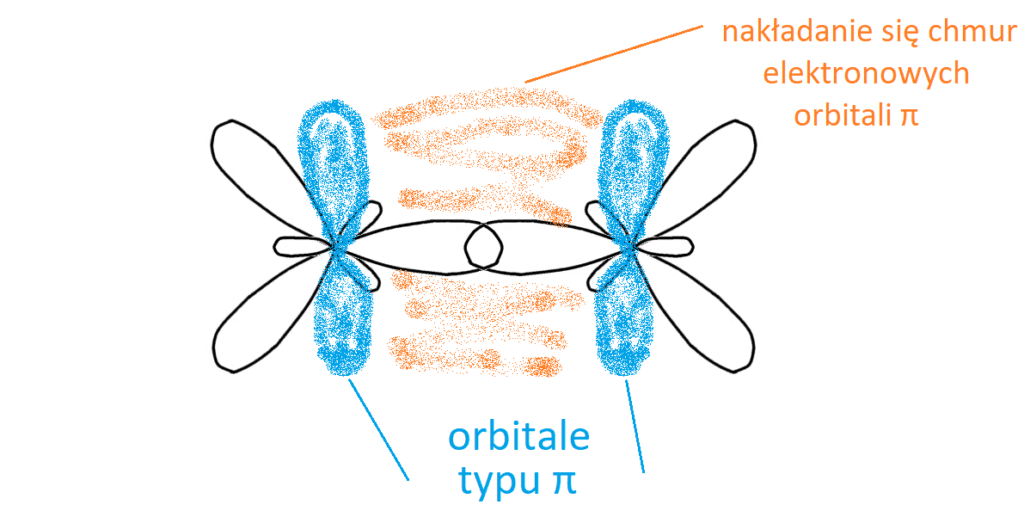
Boczne nakładanie się orbitali powoduje, że siła takiego wiązania jest o wiele słabsza, wiązanie takie jest krótsze i bardziej podatne na reakcje.
Podsumowując, hybrydyzacja która często w podręcznikach licealnych omawiana jest w sposób bardzo matematyczny, instrumentalny i pozbawiony analizy jej znaczenia, jest w gruncie rzeczy bardzo logicznym procesem. Elektrony ulegają hybrydyzacji po to, aby:
- dany atom centralny mógł wytwarzać jak największą liczbę wiązań (wzbudzenie)
- wszystkie wiązania miały jednakową energię (w tym wolne pary mogące tworzyć wiązania koordynacyjne)
Nie zawsze wszystkie elektrony po hybrydyzacji wpływają na kształt danej cząsteczki. Obecność wolnych par elektronowych może powodować, że kształt danej cząsteczki nie wiąże się w sposób bezpośredni z podstawowym kształtem w danej hybrydyzacji.
Pozdrawiam.
Łukasz Lijewski – AKADEMIA CHEMII
Wszelkie prawa zastrzeżone!!!
Zamieszczanie jakichkolwiek fragmentów tego artykułu w innych publikacjach i stronach internetowych bez zgody autora jest zabronione.